
| 起始浓度/mol•L-1 | 3 | 1 | 0 |
| 2s末浓度/mol•L-1 | 1.8 | 0.6 | 0.8 |
| A. | 0.4 mol•L-1•s-1 | B. | 0.2 mol•L-1•s-1 | C. | 0.8 mol•L-1•s-1 | D. | 0.6 mol•L-1•s-1 |
分析 根据表中数据可知,起始浓度为0、2s末浓度为0.8mol/L的表示的是氨气的浓度变化,然后根据v=$\frac{△c}{△t}$计算出用NH3的浓度的增加来表示该反应的反应速率.
解答 解:第1、2组反应物浓度都减小,只有第三组的浓度增加,则氨气的浓度增加为:0.8mol/L,
所以用NH3的浓度的增加来表示该反应的反应速率为:v(NH3)=$\frac{0.8mol/L}{2s}$=0.4 mol•L-1•s-1,
故选A.
点评 本题考查了化学反应速率的计算,题目难度不大,根据浓度变化正确判断反应物、生成物的浓度变化为解答关键,注意掌握化学反应速率的表达式,试题培养了学生的化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
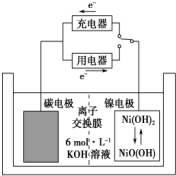 一种碳纳米管能够吸附氢气,可作二次电池(如图所示)的碳电极.该电池的电解质溶液为6mol•L-1的KOH溶液,下列说法中不正确的是( )
一种碳纳米管能够吸附氢气,可作二次电池(如图所示)的碳电极.该电池的电解质溶液为6mol•L-1的KOH溶液,下列说法中不正确的是( )| A. | 充电时阴极反应:2H2O+2e-═2OH-+H2↑ | |
| B. | 充电时将碳电极与电源的负极相连 | |
| C. | 放电时,OH-移向碳电极 | |
| D. | 放电时镍电极反应为:Ni(OH)2+OH--e-═NiO(OH)+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1 mol•L-1 HA溶液的pH=3,则HA的电离:HA=H++A- | |
| B. | 向硫酸铵溶液中加入适量氨水,当溶液呈酸性时,溶液中c(SO42-)=c(NH4+) | |
| C. | 向1 mL 2 mol•L-1NaOH溶液中滴加1~2滴0.1 mol•L-1MgCl2溶液后,再滴加2滴0.1 mol•L-1 FeCl3溶液:Mg2++2OH-=Mg(OH)2↓,3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ | |
| D. | 浓度相等的①NH4HSO4②NH4C1③(NH4)2SO4溶液中,c(NH4+)的大小顺序为③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
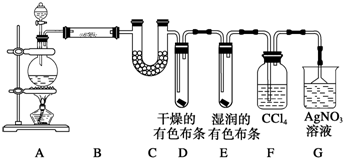 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①②③ | C. | ①④⑤ | D. | ①②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com