
在稀硫酸酸化的含6 mol KI溶液中逐滴加入KBrO3溶液,整个过程中含碘物质与所加入KBrO3物质的量的关系如图。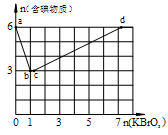
请回答下列问题:
(1)b点时,对应含碘物质的化学式为 。
(2)b→c过程中,仅有一种元素发生化合价变化, 写出该反应的化学方程式 。
(3)当n(KBrO3)=4mol时,体系中对应含碘物质的化学式为 。
(4)酸性条件下,Br2、IO3-、BrO3-、I2氧化性由强到弱的顺序为 。
(5)在稀硫酸酸化的KBrO3溶液中不断滴入淀粉KI溶液,边滴边振荡。则实验过程中的可能观察到的现象为 。
(1)I2;(2分)
(2)KBrO3+KBr+6H2SO4=3Br2+3H2O+3K2SO4(2分)
(3)KIO3和I2(2分)
(4)BrO3- > IO3- > Br2 > I2(2分)。
(5)溶液先无色,后变蓝色,合理给分(2分)
解析试题分析:(1)KBrO3溶液是强氧化剂,加入KI溶液,能够将碘离子氧化为I2;从含碘物质的物质的量的变化上也可以看出,一定是生成碘单质。
(2)b→c过程中,仅有一种元素发生化合价变化,我们从图上可以看出,含碘物质的物质的量并没有发生变化,那一定是别的物质的氧化还原反应了,在这个反应中,除了碘的化合价可以变化外, 也就只有溴元素了,因此反应为:KBrO3+KBr+6H2SO4=3Br2+3H2O+3K2SO4
(3)当n(KBrO3)=4mol时,体系中对应含碘物质的物质的量小于6mol,也就是说并没有完全转变为负一价的溴,应该是混合物,化学式为KIO3和I2
(4)依据同一反应中,氧化剂氧化性大于氧化产物的氧化性可知:BrO3- > IO3- > Br2 > I2。
(5)溶液先无色,后变蓝色,
考点:考查氧化还原反应。


科目:高中化学 来源: 题型:填空题
(1)火山喷发所产生的硫黄可用于生产重要的化工原料硫酸。某企业用如图所示的工艺流程生产硫酸。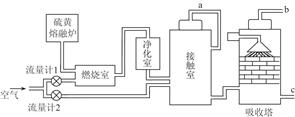
请回答下列问题:
①为充分利用反应放出的热量,接触室中应安装 (填设备名称)。吸收塔中填充有许多瓷管,其作用是 。
②为使硫黄充分燃烧,经流量计1通入燃烧室的氧气过量50%。为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为 。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 。(空气中氧气的体积分数按0.2计),该尾气的处理方法是 _。
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是 (可多选)。
A.耗氧量减少
B.二氧化硫的转化率提高
C.产生的废气减少
D.不需要使用催化剂
(2)硫酸的用途非常广泛,可应用于下列哪些方面 (可多选)。
A.橡胶的硫化
B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产
D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
SO2是一种重要的化工原料,也是一种环境污染物。
(1)SO2可用于工业制Br2过程中吸收潮湿空气中的Br2,反应的离子方程式是 。
(2)直接排放含SO2的烟气会形成酸雨,危害环境。用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(3)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol?L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
①此时溶液中c(SO32-)的浓度是0.2 mol?L-1,则溶液中c(HSO3-)是_________mol?L-1,由此说明NaHSO3溶液显 性,用化学平衡原理解释: 。
②向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
标准状况,体积相同的四支试管中分别盛满Cl2、NH3、SO2和NO2,分别倒立在盛有足量水的水槽中(假设进入试管的液体不扩散),光照充分溶解。
(1)从物质分类的角度可以推测物质的性质。其中SO2属于_______氧化物(填“酸性”、“碱性”或“两性”)。
SO2 + ( ) → 含氧酸盐。
SO2 + ( ) → 盐 + ( )。
(2)装有NO2的试管倒立在盛有足量水的水槽时,反应的化学方程式为___________________。实验现象为______________________________________________________________________。
(3)装有NH3的试管进行实验时,实验完毕试管内溶液的物质的量浓度为 。
(4)装有Cl2的试管倒立在盛有足量水的水槽中经过充分的光照,实验结束试管中剩余的气体是 ,生成该气体先后发生的化学方程式有 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图表示在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹。(氯气在饱和氯化钠溶液中的溶解度较小。)
(1)仪器A的名称是 ;水槽中应盛放的是 ;烧杯中盛放的是 ;烧瓶中反应的化学方程式 ;
在收集氯气时,应打开 关闭 (填a, b)当氯气收集完毕,尾气处理时烧杯中发生反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D为中学化学四种常见物质,A为红棕色气体,它们之间的相互转化关系如右图。已知:A+H2O→M+C;D+H2O→N,M、N是酸雨的主要成分。
(1)写出下列反应化学方程式
①A+H2O→M+C 。
②A+B→C+D 。
(2)下列哪些物质不能与N的浓溶液反应 。
a.NH3 b.H2 c.SO2 d.H2S
(3)下列实验方案可以用于在实验室制取B的是 。
a.Na2SO3溶液与HNO3 b.Na2SO3固体与浓硫酸
c.固体硫在纯氧中燃烧 d.铜与浓H2SO4加热
(4)某同学认为:将A通入到Na2S溶液中能够证明A的氧化性,此说法是否正确 (填“是”或“否”),请说明理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某化学兴趣小组的同学为进行物质性质的探究,用维持烧瓶内压强与分液漏斗内压强相等,使液体能顺利滴下
下图所示装置进行实验。请回答下列问题:(加热及固定装置已略去)
(1)装置A中反应的化学方程式为
(2)装置C 中的试剂是 ( 填序号).
A.氢氧化钠溶液 B. 酸性高锰酸钾溶液 C.亚硫酸氢钠溶液
发生反应的离子方程式为 ,其说明了SO2具有 ,该实验操作的名称是 。
(3)在上述实验中,能说明碳的非金属性比硅强的实验现象是
(4)B中的溶液无明显现象,当滴加氯水时有白色沉淀,写出SO2表现还原性并生成白色沉淀的总离子方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
我校化学兴趣小组的学生对某品牌的消毒液的成分和性质进行实验探究:
①该消毒液外观无色透明,取适量滴加AgNO3溶液生成白色沉淀(该沉淀不溶于硝酸);
②用干燥洁净玻璃棒蘸取消毒液,点到pH试纸上,试纸先变蓝后褪色;
③取适量消毒液,滴加稀硫酸后,有黄绿色气体生成;
④用洁净铂丝蘸取消毒液,在无色灯焰上灼烧,火焰呈黄色。
⑤取适量消毒液,通入少量H2S气体,先看到有“浅黄色沉淀”,后又“澄清”。取澄清溶液适量,滴加BaCl2溶液,有白色沉淀生成(该沉淀不溶于盐酸)。
请回答以下问题:
(1)该消毒液的主要成分是_______________________________________。
(2)pH试纸颜色的变化说明消毒液溶液具有的性质是 _________________。
(3)实验③中的离子方程式为_______________________________________。
(4)实验⑤中,有“浅黄色沉淀”生成时的离子方程式为_________________________,又“澄清”时的离子方程式为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
有一硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀;滤液与4mol·L-1NaOH溶液反应,用去40mLNaOH溶液时恰好完全中和。试求:
(1)混合液中H2SO4、HNO3的物质的量浓度各是多少?
(2)另取10mL原混合液,加入4.48g铜粉共热时,收集到气体在标准状况下的体积为多少毫升?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com