
ijͬѧ��Ҫ����450 mL 0.5 mol��L��1��NaOH��Һ���Իش��������⣺
��1����ɱ�ʵ��Ӧѡ��_______mL������ƿ��
��2��������NaOH���������Ϊ________��
��3�����ܽ�����в�������������___________________________��
��4��ת�ơ�ϴ�������Ƶ���Һ��ϴ���ձ�2��3�ε�Ŀ����_________________��
��5���ڶ��ݵμ�����ˮʱ�������������˿̶��ߣ������ķ����� ��
��6���ж������������������ҺŨ�ȵ�Ӱ�죨�ƫ����ƫС��������Ӱ�족��
A��ϴ��������ƿ�в���������ˮ �� |
B��ת�ƹ��������õ��ձ���������δϴ�� �� |
C������ʱ����Һ�� �� |
D������ҡ�Ⱥ���Һ����ڿ̶����ּ�������ˮ�����̶��� �� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�갲��ʡ����У�߶�����ĩ��ѧ���������棩 ���ͣ������
��Ԫ�ؿ��γɶ��ֻ�����ڹ�ҵ�����о�����Ҫ��ֵ�� ��ش��������⣺
��1����֪��1molH��H ����1molN��H���� 1molN��N���ֱ���Ҫ��������436kJ��391kJ��946kJ����N2��H2��Ӧ�ϳ�NH3���Ȼ�ѧ����ʽΪ ______________________��
��2��һ���¶��£�2L�ܱ������г���0.40 mol N2O4��������Ӧ��N2O4(g) 2NO2(g)��һ��ʱ���ﵽƽ�⣬����������£�
2NO2(g)��һ��ʱ���ﵽƽ�⣬����������£�
ʱ�䣯s | 20 | 40 | 60 | 80 | 100 |
C(NO2)/(mol/L) | 0��12 | 0��20 | 0��26 | 0��30 | 0.30 |
��20 s�ڣ�v(NO2)=___________mol��L-1��s-1��
�������¶�ʱ��������ɫ���������Ӧ��_________(����ȡ������ȡ�)��Ӧ��
�۸��¶��·�Ӧ�Ļ�ѧƽ�ⳣ����ֵΪ_____________��
����ͬ�¶��£�����ʼ��������г���0.80molNO2����ﵽƽ���: c(NO2) ______ 0��30mol��L-1(�>���� ��=����<��)
��3��N2O5��һ�������������������ʺ��Ʊ������ǹ�ע������ H2��O2�������� Z(Na2CO3)��ɵ�ȼ�ϵ�ص���Ʊ�N2O5��װ����ͼ��ʾ������YΪCO2��
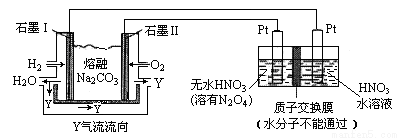
��д��ʯīI�缫�Ϸ�����Ӧ�ĵ缫��Ӧʽ _____________________________��
���ڵ���������N2O5�ĵ缫��ӦʽΪ ____________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���Ĵ�ʡ�����и߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ������
��1���״���CH3OH����һ����Ҫ�Ļ���ԭ�ϣ��㷺Ӧ���ڻ���������Ҳ����ֱ������ȼ�ϡ���֪���״���ȼ����486ΪkJ��mol-1 �� 2CO (g) + O2(g) = 2CO2(g) ��H b =��566.0 kJ��mol-1��
��д��CH3OH(l)����������ȫȼ������CO��H2O��l�����Ȼ�ѧ����ʽ�� ��
��2��������ij��Һ����ˮ�����c(H��)��10��10 mol/L�������Һ��pHΪ _______��
��3�������£���V L pH��12��Ba(OH)2��Һ����μ���һ��Ũ�ȵ�NaHSO4ϡ��Һ������Һ�е�Ba2��ǡ�ó�����ȫʱ����ҺpH��11����Ba(OH)2��Һ��NaHSO4��Һ�������Ϊ__________��NaHSO4��Һ�����ʵ���Ũ��Ϊ ��
��4�������£�0.5mol/L��NH4Cl��Һ��ΪpH=5.����Һ�����Ե�ԭ���ǣ������ӷ���ʽ��ʾ�� �����㳣���°�ˮ�ĵ���ƽ�ⳣ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���Ĵ�ʡ�����и߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
����������100 mL 0.01 mol��L-1��ϡ���ᷴӦ����Ӧ����̫����Ϊ�˼ӿ�˷�Ӧ���ʶ����ı�H2�IJ���������ʹ�����·����еģ� ��
�ټ�H2O �ڼ�NaOH���� �۵��뼸��Ũ���� �ܼ�CH3COONa���� �ݼ�NaCl��Һ ���뼸������ͭ��Һ �������¶ȣ�����������ӷ��������10 mL 0.1 mol/L����
A���٢ޢ� B���ۢݢ� C���ۢߢ� D���ݢߢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���Ĵ�ʡ�����и߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
���д�ʩ����ʵ��������ɳ����ԭ�����͵��� �� ��
A���μӷ�̪�İ�ˮ�м����Ȼ�粒�����ɫ��dz
B���غ�ɫ��NO2��ѹ����ɫ�ȱ�����dz����֪: 2NO2 (g)  N2O4 (g)��
N2O4 (g)��
C����ҵ����������Ĺ����У�ʹ�ù����Ŀ��������SO2��������
D������������ȥ��ůˮƿ�е�ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���Ĵ�ʡ�㰲�и�һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
�ں���Fe3+��Fe2+��Al3+��Cl������Һ�У����������Na2O2���ȣ���ַ�Ӧ���ټ��������ϡ���ᣬ��ȫ��Ӧ���������ӵ���Ŀû�����Ա仯����
A��Al3+ B��Fe2+ C��Fe3+ D��Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���Ĵ�ʡ�㰲�и�һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
���и����е����ӣ�������ɫ��Һ�д����������
A��H���� K���� CO32���� SO42�� B��Fe3+��Na����NO3����SO42��
C��Mg2+��Ba2+��OH����NO3��  D��K����Mg2+��NO3����Cl��
D��K����Mg2+��NO3����Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�켪��ʡ�������������Ļ�ѧ���������棩 ���ͣ�ʵ����
�����к������أ��ֲ�Ӧ�ÿ���������ʹ���������������Ľṹ���Ա�ʾΪ�� (RΪ����)������һ���������������J�ĺϳ�·�����£�
(RΪ����)������һ���������������J�ĺϳ�·�����£�

��֪��
��A��B��EΪͬϵ�����B����Է�������Ϊ44��A��B�˴Ź���������ʾ��������壬������ȷֱ�Ϊ9��1��3��1��
�ڻ�����J�ķ���ʽΪC15H22O4��
��
�ش��������⣺
��1��G�к��еĹ������� �� ��
��2����C����D�ķ�Ӧ����Ϊ ��D�Ļ�ѧ����Ϊ ��
��3���ٵĻ�ѧ����ʽΪ ��
��4��J�Ľṹ��ʽΪ ��
��5��G��ͬ���칹���У������ϵ�һ�ȴ���ֻ��һ�ֵĹ��� ��(���������칹)���˴Ź���������ʾ2������ (д�ṹ��ʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ�����и������ʼ����ѧ���������棩 ���ͣ�ѡ����
����ʵ����Ƽ����Ӧ�����ӷ���ʽ����ȷ����
A����Ũ��������м��Ӧ��ȡH2��2Fe+6H +=2Fe3++3H2��
+=2Fe3++3H2��
B����Ũ�����ữ��KMnO4��Һ��H2O2��Ӧ��֤��H2O2���л�ԭ�ԣ�
2MnO4-+6H++5H2O2��2Mn2++5O2��+8H2O
C���ô����ȥˮ����CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2����
D������������ˮ�Ʊ������Cl2+H2O��2H++Cl-+ClO-
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com