
| A. | Cl2通入Na2CO3溶液中 | B. | CO2通入CaCl2溶液中 | ||
| C. | NH3通入AgNO3溶液中 | D. | SO2通入NaHS溶液中 |
分析 A、氯气与水反应生成次氯酸和盐酸,盐酸与碳酸钠反应,生成二氧化碳气体;
B、氯化钙不与二氧化碳反应;
C、一开始是酸碱中和,没有沉淀产生,当硝酸完全中和后,氨水与银离子生成氢氧化银沉淀,逐渐增多,达到最大时,氢氧化银沉淀和氨水发生络合,生成可溶的银氨络离子,直至沉淀全部溶解;
D、SO2通入NaHS溶液中,发生氧化还原反应,生成淡黄色固体.
解答 解:A、氯气与水反应生成次氯酸和盐酸,盐酸与碳酸钠反应,生成二氧化碳气体,所以有气体产生,故A不选;
B、氯化钙和二氧化碳不符合离子发生反应的条件,故不发生反应,溶液不会变浑浊,所以无现象,故选B;
C、NH3通入硝酸和硝酸银的混合溶液中,先与硝酸反应,故开始没有沉淀,等硝酸全部反应完全后,再与硝酸银反应生成氢氧化银沉淀,再继续通入氨气会生成可溶性的银氨溶液,故沉淀又会减少,直至最终没有沉淀,反应方程式为NH3+HNO3=NH4NO3、NH3+AgNO3+H2O=AgOH↓+NH4NO3、AgOH+2NH3=Ag(NH3)2OH(银氨溶液),故C不选;
D、SO2通入NaHS溶液中,发生氧化还原反应,生成淡黄色固体,故D不选;
故选B.
点评 本题考查物质的性质,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重元素化合物知识的综合考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
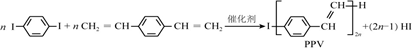
| A. | 合成PPV的反应为加聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. |  和苯乙烯互为同系物 和苯乙烯互为同系物 | |
| D. | 通过质谱法测定PPV的平均相对分子质量,可得其聚合度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 溶液出现蓝色且30s内不褪色
溶液出现蓝色且30s内不褪色查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液中,2c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| B. | 强碱弱酸盐NaA溶液的pH=8,则c(OH-)-c(HA)=1,0×10-8mol/L | |
| C. | KAl(SO4)2溶液中,c(SO42-)>c(K+)=c(Al3+)>c(H+)>c(OH-) | |
| D. | 向100ml pH=12 的 NaOH溶液中加入pH=2的醋酸溶液至中性,所得溶液的总体积大于200ml |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打可用作糕点的膨化剂 | |
| B. | 二氧化硫可用作食品的漂白剂 | |
| C. | PX(对二甲苯)是生成塑料、聚酯纤维和薄膜的主要原料 | |
| D. | PM2.5指数是雾霾天气监测中的重要指标 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、D、T三种氢的核素在周期表中的位置不同 | |
| B. | 元素简单气态氢化物越稳定,则非金属性越强 | |
| C. | 核外电子层结构相同的离子,核电荷数越大其离子半径也越大 | |
| D. | ⅠA与ⅦA元素形成的化合物都是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:
为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:| 操作 | 现象和结论 |
| ①取-定量2mol/L NaCl溶液,调 节溶液pH为4.91:再以相间装置进行电解. ②电解相同时间后,若电极b表面无气泡,取少量阳极附近的溶液,滴入淀粉KI溶液 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com