
| 选项 | a | b | c | d |
| A | Pt | Pt | NaOH | NaOH |
| B | C | C | NaCl | NaOH |
| C | Cu | Cu | CuSO4 | Cu(OH)2 |
| D | Pt | Pt | H2SO4 | H2O |
| A. | A | B. | B | C. | C | D. | D |
分析 用b作阴极,a作阳极,电解c的水溶液,电解一段时间后,再加入d能使溶液恢复到电解前的状态,应首先根据电解原理确定两个电极反应,并判断电解产物,要满足溶液浓度不变,根据“出什么加什么”来确定加入的物质.
解答 解:A、电解NaOH溶液实际上是电解的水,加入一定量的水可恢复原浓度,故A错误;
B、电解食盐水,生成NaOH、H2、Cl2,加盐酸显然不能恢复电解前的状态,应通入适量的HCl气体,故B错误;
C、阴极上是铜离子得电子的反应,产生金属铜,阳极是铜放电,则溶液浓度不变,加入CuSO4则CuSO4浓度增大,故C错误;
D、电解硫酸溶液实际上是电解的水,加入一定量的水可恢复原浓度,故D正确;
故选D.
点评 本题考查电解原理,解答本题要注意把握两极的反应,注意要满足溶液浓度不变,应再加入电解产物,学习中注意把握电解原理和阴阳离子的放电顺序,题目难度不大.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:选择题

| A. | K1、K2闭合时,Na+均移向铁棒 | |
| B. | K1闭合,石墨棒周围溶液pH逐渐升高 | |
| C. | K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| D. | K2闭合,电路中通过0.4NA个电子时,两极共产生标况下4.48L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KMnO4溶液 | B. | KSCN溶液 | C. | NaOH溶液 | D. | NH3•H2O溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
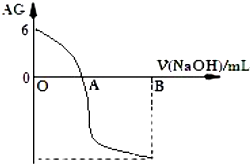
| A. | A 点时加入氢氧化钠溶液体积为 20 mL | |
| B. | OA 段溶液中:c(CH3COO-)>c(CH3COOH) | |
| C. | 室温时 0.01 mol/L的醋酸溶液 pH=4 | |
| D. | 若 B 点时加入 NaOH 溶液为 40 mL,所得溶液中:c(CH3COO-)+c(CH3COOH)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(HCN)>c(CN-) | B. | c(Na+)<c(CN-) | ||
| C. | c(HCN)-c(CN-)=c(OH-) | D. | c(HCN)+c(CN-)=2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.2 mol/L的一元酸HA溶液和0.1 mol/L的NaOH溶液混合,混合液中一定有:c(OH-)+c(A-)=c(H+)+c(Na+) | |
| B. | 某溶液中由水电离出的c(OH-)=1×10-9mol/L,则该溶液的pH一定为5 | |
| C. | 室温下,NaHSO3溶液的pH<7,则溶液中c(SO32-)<c(H2SO3) | |
| D. | Na2CO3溶液与NaHCO3溶液混合一定有2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于7.1g | B. | 小于7.1g | ||
| C. | 大于7.1g,小于14.2g | D. | 大于14.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com