
【题目】实验室利用SO2和Cl2在活性炭作用下制取SO2C12,原理为SO2(g)+Cl2(g)SO2Cl2(l) H=-97.3kJ/mol。装置如图所示(部分装置已省略)。已知SO2C12的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。下列说法正确的是

A.乙中盛放的试剂为无水氯化钙
B.制备过程中需要将装置甲置于冰水浴中
C.用来冷却的水应该从a口入,b口出
D.可用硝酸与亚硫酸钠反应制备二氧化硫
【答案】B
【解析】
SO2C12的熔沸点低、易挥发,根据装置图可知,三颈烧瓶上方的冷凝管的作用是使挥发的产物冷凝回流,由于会有一部分SO2和Cl2通过冷凝管逸出,SO2和Cl2都会污染空气,故乙装置应使用碱性试剂,SO2C12遇水能发生剧烈反应并产生白雾,乙中盛放碱石灰,吸收未反应完的二氧化硫、氯气,防止污染空气,并吸收空气中的水蒸气,防止水蒸气进入甲中导致SO2Cl2水解。
A.乙的作用是吸收未反应完的二氧化硫、氯气,防止污染空气,并吸收空气中的水蒸气,防止水蒸气进入甲中导致SO2Cl2水解,故乙中盛放的试剂应该是碱石灰,无水氯化钙只能吸收水,A选项错误;
B.根据题目中热化学方程式可知,H<0,则该反应为放热反应,降低温度使平衡正向移动,有利于提高SO2Cl2产率,B选项正确;
C.冷凝水应从冷凝管的下口进,上口出,故用来冷却的水应该从b口入,a口出,C选项错误;
D.硝酸具有氧化性,能把二氧化硫氧化成硫酸,故不可用硝酸与亚硫酸钠反应制备二氧化硫,D选项错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氯消毒剂是消毒剂中常用的一类产品。
I.某实验小组用如图装置制备家用消毒液。
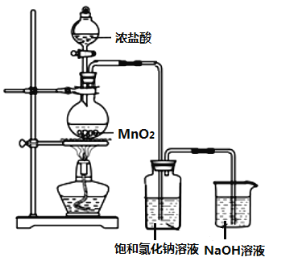
(1)图中盛装浓盐酸的仪器名称是___,写出利用上述装置制备消毒液涉及反应的化学方程式,制氯气:___、制消毒液:___。此方法获得的消毒液的有效成分是___(填名称)。
(2)洗气瓶中饱和食盐水的作用是___。
(3)此消毒液在使用时应注意一些事项,下列说法正确的是___。
a.可以用于衣物消毒
b.可以用于瓷砖、大理石地面的消毒
c.可以用于皮肤消毒
d.与洁厕灵(含盐酸)混合使用效果更好
(4)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气)若反应中消耗Cl21.5mol,则被氧化的NH3在标准状况下的体积为___L,该过程中电子转移的总数为___个。
II.(5)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。氯酸钠与盐酸在50℃的条件下反应得到二氧化氯和氯气的混合气体。控制50℃的加热方法是___,写出该反应的化学方程式___。
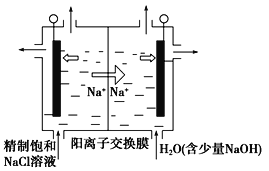
(6)目前已开发出用电解法制取ClO2的新工艺。
如图所示,用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,能较长时间保持稳定的放电电压。高铁电池放电时总反应为3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
(1)高铁电池的负极材料是______。
(2)放电时,正极发生________(填“氧化”或“还原”)反应。
(3)负极电极反应式为______________,正极电极反应式为______________正极附近溶液的碱性_____(填“增强,减弱,不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆 开)1mol 化学键时释放(或吸收)的能量。已知白磷和![]() 的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P—P:198,P—O:360,O=O:498,则对于反应
的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P—P:198,P—O:360,O=O:498,则对于反应![]() 表述正确的是 ( )
表述正确的是 ( )
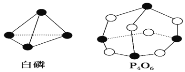
A.放出1638 kJ 的热量B.吸收1638 kJ 的热量
C.放出126 kJ 的热量D.吸收126 kJ 的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁—次氯酸盐电池的工作原理如图,该电池反应为:Mg+ClO-+H2O=Mg(OH)2+Cl-。下列有关说法正确的是( )
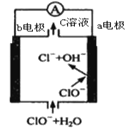
A.电池工作时,正极a附近的pH将不断增大
B.电池工作时,c溶液中的溶质是MgCl2
C.负极反应式:ClO-+2e-+H2O=Cl-+2OH-
D.a电极发生还原反应,每转移0.2mol电子,理论上生成0.2molCl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列提供的一组物质回答问题:
①NH4Cl ②MgCl2 ③H2S ④Na2O2 ⑤MgO ⑥Cl2 ⑦NaOH ⑧H2O2 ⑨NH3 ⑩CO2
(1)既有极性共价键又有非极性共价键的是__(用序号表示)。
(2)既有离子键又有共价键的是__(用序号表示)。
(3)共价化合物有___(用序号表示)。
(4)CO2的电子式___;Na2O2的电子式__。
(5)用电子式表示MgCl2的形成过程:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸H2A在水溶液中发生电离:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-。下列叙述不正确的是( )
H++A2-。下列叙述不正确的是( )
A. 在NaHA溶液中一定是:c(Na+)>c(HA-)>c(OH-)>c(H+)
B. 在Na2A溶液中一定是:c(Na+)>c(A2-)>c(OH-)>c(H+)
C. 在NaHA溶液中一定是:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-)
D. 在H2A溶液中一定是:c(H+)=c(HA-)+2c(A2-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行如下实验,研究化学反应中的热量变化。

请回答下列问题:
(1)反应后①中温度升高,②中温度降低。由此判断铝条与盐酸的反应是________反应(填“放热”或“吸热”,下同),Ba(OH)2·8H2O与NH4Cl的反应是________反应。
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为______,表示其中和热的热化学方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com