
 的是( )
的是( )| A. | NaCl | B. | HCl | C. | NaOH | D. | HNO3 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
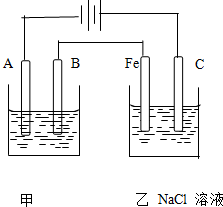 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,加入适量稀盐酸或稀硫酸, 在溶液中加入硫氰化钾溶液 | 溶液不变红色,则假设一成立, 溶液变成红色,则假设一不成立 |
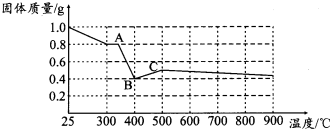
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Fe3+、Cl-、H+ | B. | Fe2+、SO42-、CO32-、NO3- | ||
| C. | Ba2+、NO3-、Cl-、Na+ | D. | K+、NH4+、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25 mL 0.5 mol•L-1HCl 溶液 | B. | 200 mL 0.25 mol•L-1 AlCl3溶液 | ||
| C. | 50 mL 1 mol•L-1 KCl 溶液 | D. | 100 mL 0.5 mol•L-1 MgCl2 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2属于碱性氧化物 | |
| B. | 酸雨是pH小于7的雨水 | |
| C. | CO2、NO2或SO2都会导致酸雨的形成 | |
| D. | 大雾是一种胶体,能发生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com