
| A、它是一种非极性分子 |
| B、它还能以配位键跟Cl-结合 |
| C、它的沸点比PCl3更高 |
| D、已知NBr3对光很敏感,故NCl3也具有光敏性 |
 ,Cl-的电子式
,Cl-的电子式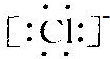 ,由两者的电子式知,N、Cl两原子的最外层都达8电子稳定结构,故不可能形成配位键,故B错误;
,由两者的电子式知,N、Cl两原子的最外层都达8电子稳定结构,故不可能形成配位键,故B错误;

科目:高中化学 来源: 题型:
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1mol N2、3mol H2 | 2mol NH3 | 2mol NH3 |
| 平衡时容器体积 | V甲 | V乙 | V丙 |
| 反应的平衡常数K= | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度/mol?L-1 | c甲 | c乙 | c丙 |
| 平衡时NH3的反应速率/mol?L-1?min-1 | v甲 | v乙 | v丙 |
| A、V甲>V丙 |
| B、K乙>K丙 |
| C、c乙>c甲 |
| D、v甲=v丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1的NaF溶液中所含F-的数目小于0.1NA |
| B、标准状况下,2.24 L乙醇中含有的C-H键数目为0.5NA |
| C、0.l mol O3和O2的混合气体中含氧原子数目为0.2NA |
| D、0.1 mol NA完全被氧化生成Na2O2,转移电子的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
206 82 |
207 82 |
| A、含不同的质子数 |
| B、含不同的电子数 |
| C、含相同的中子数 |
| D、互相转化时不属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图周期表中短周期元素的一部分,已知A和B原子核质子数均均与中子数相等,且A2的分子量等于B的原子量.
如图周期表中短周期元素的一部分,已知A和B原子核质子数均均与中子数相等,且A2的分子量等于B的原子量.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe和Mg与0.1 mol?L-1的盐酸反应,反应速率相同 |
| B、0.1 mol?L-1的盐酸与0.1 mol?L-1 H2SO4分别与大小、形状相同的大理石反应,反应速率相同 |
| C、催化剂能降低分子活化时所需能量,使单位体积内活化分子百分数大大增加 |
| D、100 mL 2 mol?L-1的盐酸与锌片反应,加入适量的NaCl溶液,反应速率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Ba2+、Cl-、SO42- |
| B、K+、Na+、OH-、NO3- |
| C、H+、NH4+、Fe3+、SO42- |
| D、H+、Cl-、CH3COO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com