
| A. | 0.05mol•L-1 | B. | 0.1 mol•L-1 | C. | 0.5 mol•L-1 | D. | 1 mol•L-1 |
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:填空题
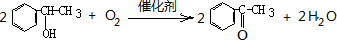 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ||||||||||||||
| ⑥ | ⑦ | ⑧ | |||||||||||||||
| ⑨ | ⑩ |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
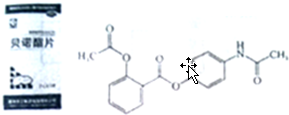
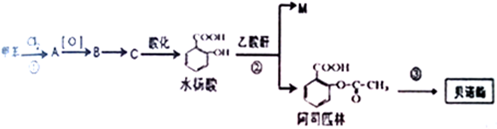
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/K | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
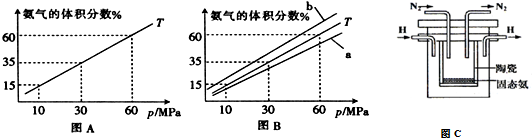
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 向硫酸钠溶液中滴加氯化钡溶液 Ba2++SO42-═BaSO4↓ | |
| C. | 氯水加入到溴化钾溶液中 Br-+Cl2═Br2+Cl- | |
| D. | 碳酸钙溶于稀盐酸 CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 日常生活中的手电筒干电池通常是锌锰电池,其构造示意图如下:
日常生活中的手电筒干电池通常是锌锰电池,其构造示意图如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
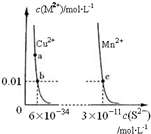
| A. | 该温度下,Ksp(CuS)小于Ksp(MnS) | |
| B. | 向CuSO4溶液中加入MnS发生如下反应:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq) | |
| C. | 在含有CuS和MnS固体的溶液中c(Cu2+):c(Mn2+)为2×10-23:1 | |
| D. | a点对应的 Ksp大于b点对应的Ksp |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com