
【题目】如图为碳元素的价类二维图,结合图中的物质部分转化关系,完成下列问题:
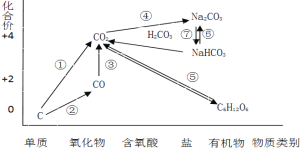
(1)下列说法正确的是 __________
a.要实现反应①一定要与氧化剂作用
b.要实现反应②一定要与还原剂作用
c.在一定条件下木炭与浓硝酸能实现 反应①转化
d.反应⑤属于非氧化还原反应
(2)下列有关碳及其化合物类别及性质说法不正确的是__________
a.CO不属于酸性氧化物,具有还原性
b.CO2属于酸性氧化物,可以与碱反应生成碳酸盐
c.NaHCO3属于弱酸的酸式盐,既能与硫酸反应又能与NaOH反应
d.金刚石和石墨互为同素异形体,其物理性质和化学性质均相同
(3)高炉炼铁的过程是将铁矿石(Fe2O3)还原成金属铁的过程,实现了反应③的转化,请写出其反应的化学方程式,并用“双线桥”表示电子的得失情况______________________________ 。
(4)化学活动课上,两组同学分别用如图所示甲、乙两装置探究“Na2CO3、NaHCO3与稀盐酸的反应”。按下表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。请回答:

①两组反应开始时,装置___________(填“甲”或“乙”)中的气球体积先变大,该装置中反应的离子方程式是______________________。
②当试管中不再有气体生成时,两组实验出现不同现象。
试剂用量 | 实验现象 | 分析原因 | |
第A组 | 0.84gNaHCO3 1.06gNa2CO3 6ml 4mol·L-1盐酸 | 甲中气球与乙中气球的 体积相等 | 甲、乙盐酸均过量 n(NaHCO3)= n(Na2CO3) V(CO2)甲=V(CO2)乙 |
第B组 | 1.2gNaHCO3 1.2gNa2CO3 6ml 2mol·L-1盐酸 | 甲中气球比乙中气球的体积大 片刻后,乙中气球又缩小,甲中气球的体积基本不变 |
|
按上表第A组原因分析方法,分析第B组实验甲中气球为比乙中气球体积大的原因__________。用离子方程式表示第B组乙中气球又缩小的原因:______________。
【答案】A C D  甲 H++HCO3-=CO2↑+H2O 甲、乙盐酸均不足,消耗的n(NaHCO3)﹥n(Na2CO3) ,V(CO2)甲﹥V(CO2)乙 CO32-+CO2+H2O=2HCO3-
甲 H++HCO3-=CO2↑+H2O 甲、乙盐酸均不足,消耗的n(NaHCO3)﹥n(Na2CO3) ,V(CO2)甲﹥V(CO2)乙 CO32-+CO2+H2O=2HCO3-
【解析】
(1)根据氧化还原反应的有关规律判断;
(2)a. CO不属于酸性氧化物,C元素化合价为+2价,具有还原性,故a正确;
b. CO2属于酸性氧化物,可以与碱反应生成碳酸盐,故b正确;
c. NaHCO3属于弱酸的酸式盐,既能与硫酸反应生成二氧化碳和水,又能与NaOH反应生成碳酸钠,故c正确;
d. 金刚石和石墨互为同素异形体,其化学性质相似,物理性质有很大差异,故d错误;
(3)Fe2O3在高温下可以被CO还原成Fe单质,Fe元素由+3价下降到0价,得到3个电子;
(4)①碳酸氢钠和盐酸反应的速率更快;
②按上表第A组原因分析方法,分析第B组实验中反应物之间的数量关系,二氧化碳可以溶于碳酸钠溶液中。
(1)a.①C ![]() CO2,C化合价升高作为还原剂,需要加入氧化剂才能实现,故a正确;
CO2,C化合价升高作为还原剂,需要加入氧化剂才能实现,故a正确;
b.①C ![]() CO,C化合价升高作为还原剂,需要加入氧化剂才能实现,故b错误;
CO,C化合价升高作为还原剂,需要加入氧化剂才能实现,故b错误;
c.木炭与浓硝酸在加热的条件下可以生成二氧化碳,可以实现反应①转化,故c正确;
d. 反应⑤中C化合价变化,属于氧化还原反应,故d错误;
正确答案是ac;
(2)a. CO不属于酸性氧化物,C元素化合价为+2价,具有还原性,故a正确;
b. CO2属于酸性氧化物,可以与碱反应生成碳酸盐,故b正确;
c. NaHCO3属于弱酸的酸式盐,既能与硫酸反应生成二氧化碳和水,又能与NaOH反应生成碳酸钠,故c正确;
d. 金刚石和石墨互为同素异形体,其化学性质相似,物理性质有很大差异,故d错误;
题目要求选错的,故选d;
(3)Fe2O3在高温下可以被CO还原成Fe单质,Fe元素由+3价下降到0价,得到3个电子,用“双线桥”表示电子的得失情况为:
(4)①碳酸钠和盐酸的反应可以分成两步:第一步Na2CO3+HCl=NaHCO3+NaCl,第二步 NaHCO3+HCl=NaCl+H2O+CO2![]() ,而碳酸氢钠只进行第二步反应,所以更快一些,故装置甲中的气球体积先变大,甲中发生的离子方程式是:H++HCO3-=CO2↑+H2O;
,而碳酸氢钠只进行第二步反应,所以更快一些,故装置甲中的气球体积先变大,甲中发生的离子方程式是:H++HCO3-=CO2↑+H2O;
②根据化学方程式计算可知A组中NaHCO3和Na2CO3都已完全反应。B组中,n(Na2CO3)= ![]() =0.011mol,n(NaHCO3)=
=0.011mol,n(NaHCO3)= ![]() =0.014mol,n(HCl)=0.012mol,根据反应NaHCO3+HCl =NaCl + CO2↑+H2O和Na2CO3+2HCl=2NaCl+CO2↑+H2O可知,Na2CO3、NaHCO3都过量,NaHCO3产生的CO2较Na2CO3的多。因为气体收集于气球中,乙中CO2又与过量的Na2CO3溶液反应,故甲中气球比乙中气球的体积大片刻后,乙中气球又缩小,甲中气球的体积基本不变,分析原因为:甲、乙盐酸均不足,消耗的n(NaHCO3)﹥n(Na2CO3) ,V(CO2)甲﹥V(CO2)乙;CO2与过量的Na2CO3溶液反应为:CO32-+CO2+H2O=2HCO3-。
=0.014mol,n(HCl)=0.012mol,根据反应NaHCO3+HCl =NaCl + CO2↑+H2O和Na2CO3+2HCl=2NaCl+CO2↑+H2O可知,Na2CO3、NaHCO3都过量,NaHCO3产生的CO2较Na2CO3的多。因为气体收集于气球中,乙中CO2又与过量的Na2CO3溶液反应,故甲中气球比乙中气球的体积大片刻后,乙中气球又缩小,甲中气球的体积基本不变,分析原因为:甲、乙盐酸均不足,消耗的n(NaHCO3)﹥n(Na2CO3) ,V(CO2)甲﹥V(CO2)乙;CO2与过量的Na2CO3溶液反应为:CO32-+CO2+H2O=2HCO3-。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42-。
Ⅰ.某校研究性学习小组设计下图工艺流程以回收铜和硫酸亚铁。请回答:
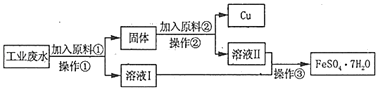
(1)加入原料①反应的离子方程式为_____
(2)操作①中用到的玻璃仪器是_____(填序号)。
a.烧杯 b.漏斗 C.玻璃棒 d.酒精灯
(3)加入原料②的名称为_____
Ⅱ.回收的铜可用于制备胆矾(CuSO45H2O)。将铜和一定浓度稀硫酸混合后在加热的情况下通入氧气,发生如下反应:2Cu+2H2SO4+O2═2CuSO4+2H2O,制得硫酸铜溶液后,经过蒸发浓缩冷却结晶、过滤可得胆矾
(1)请分析2Cu+2H2SO4+O2![]() 2CuSO4+2H2O反应中,氧化剂是_____氧化产物是_____(填化学式)
2CuSO4+2H2O反应中,氧化剂是_____氧化产物是_____(填化学式)
(2)用双线桥标出反应中电子转移的方向和数目______________________
(3)若有147gH2SO4参与反应,则反应转移的电子数目为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
A. 
B. 
C. 
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷对水体的污染情况越来越受到人们的重视。回答下列问题:
(1)常温下,在pH约为9时,用澄清石灰水可将水体中的HPO42-化为Ca10(PO4)6(OH)2沉淀除去,该反应的离子方程式为_____________。
(2)除去地下水中的硝态氮通常用还原剂将其还原为N2。
①Prusse等提出的用Pd-Cu作催化剂,常温下,在pH为4.0~6.0时,可直接用H2将NO3-还原为N2,该反应的离子方程式为__________。研究发现用H2和CO2的混合气体代替H2,NO3-的去除效果比只用H2时更好,其原因是________。
②在pH约为5时,用纳米Fe粉可将NO3-还原为N2,Fe粉被氧化为Fe2+,该反应中氧化产物与还原产物的物质的量之比为_________。
(3)实验测得相同条件下,用次氯酸钠脱除水体中的氨态氮的过程中(2NH3+3ClO-=N2+3H2O+3Cl-),pH与氨态氮的去除率关系如图所示,在pH大于9时,pH越大,去除率越小,其原因是_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中的反应热下划线处表示燃烧热的是( )
A. NH3(g)+![]() O2(g)=
O2(g)=![]() N2(g)+
N2(g)+![]() H2O(g);ΔH= -a kJ·mol-1
H2O(g);ΔH= -a kJ·mol-1
B. C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l);ΔH= -b kJ·mol-1
C. C(s)+H2O(g)=CO(g)+H2(g);ΔH= -c kJ·mol-1
D. CH3CH2OH(l)+![]() O2(g)=CH3CHO(l)+H2O(l);ΔH= -d kJ·mol-1
O2(g)=CH3CHO(l)+H2O(l);ΔH= -d kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁元素是重要的金属元素,铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素具有氧化性也有还原性的物质是_________。
a.铁单质 b.氯化亚铁 c.铁红 d.Fe3O4
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO42-、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:____ Fe(OH)3+___ ClO-+_______=____FeO42-+____Cl-+______
(3)电子工业上用氯化铁腐蚀铜箔,制造印刷电路板,并从使用过的腐蚀废液(含有FeCl2、CuCl2、FeCl3)中回收铜,并获得氯化铁晶体,其工艺流程如下:回答下列问题:

①反应①的化学方程式:_______________;
②从反应①和②可以判断出Fe2+、Cu2+、Fe3+的氧化性从强到弱顺序为:____________;
③操作I用到的玻璃仪器有烧杯、玻璃棒和___________;
④滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备Cu2(OH)2CO3,其工艺流程如下:

(1)“酸浸”过程中,将矿石粉碎,其目的是__________;加热能加快矿石粉“酸浸”速率,但温度不宜过高,其原因是__________。
(2)Cu2S和硝酸反应,其还原产物为NO。已知1 mol Cu2S完全反应时转移10 mol电子。写出该反应的离子方程式:_____________________。
(3)“除铁”中加入过量氧化铜发生反应的离子方程式为___________________。
(4)从过滤3得到的滤液中可提取一种肥料,它的化学式为__________;滤渣1的主要成分是__________(填化学式)。
(5)设计实验确认过滤2得到的滤液中是否有Fe3+:___________________________。
(6)取wg辉铜矿经上述流程转化,加入agCuO,滤渣2含bgCuO,最终得cmolCu2(OH)2CO3不考虑铜元素损失)。原辉铜矿含Cu2S的质量分数为____________。(用代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按如图路线合成:

(1)写出由乙烯制取A的化学方程式:____。
(2)乙烯能使溴水和酸性KMnO4溶液褪色,二者褪色原理相同吗?_____。原因是______。
(3)以乙烯为原料,能否制得乙炔?_____。若能,请写出相关的化学方程式_______。
(4)请写出C的含有苯环的同分异构体的结构简式:______。
(5)写出甲苯与浓硝酸和浓硫酸的混合酸反应的化学方程式:_____。
(6)写出C→D的化学方程式:_______,
(7)C能发生消去反应吗?______。原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等离不开化学。
(1)普通玻璃是常见的硅酸盐产品,其主要成分的化学式为Na2CaSi6O14,以氧化物形式可表示为______。
(2)缺铁性贫血患者补充的铁,通常为硫酸亚铁的形式,而硫酸铁则没有这种药效.当用硫酸亚铁制成药片时外表要包有一层特殊的糖衣,这层糖衣的作用是______.若在酸性的硫酸亚铁溶液中通入氧气,也能得到棕黄色溶液,请写出此反应的离子方程式______.检验棕黄色溶液是否有Fe2+,可选用的试剂为______(填字母)。
A.稀硝酸B.浓硫酸C.KSCN溶液D.酸性高锰酸钾溶液
(3)从降低成本和减少环境污染的角度考虑,制取硫酸铜最好的方法是______(填字母)。
A.铜和浓硫酸反应B.铜和稀硫酸反应
C.氧化铜和硫酸反应D.铜与Fe2(SO4)3溶液反应
(4)实验室用硫酸铜晶体配制一定物质的量浓度的硫酸铜溶液,下列操作将使所配溶液物质的量浓度偏高的是______(填字母)。
A.所用的硫酸铜晶体已经部分风化失水
B.移液时不小心溅出少许溶液
C.容量瓶查漏后未经干燥就直接使用
D.定容时俯视容量瓶刻度线
E.未洗涤烧杯和玻璃棒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com