

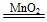 2H2O+O2↑,则
2H2O+O2↑,则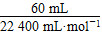 ×2≈0.005 36 mol,
×2≈0.005 36 mol,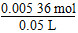 ≈0.107 mol·L-1。
≈0.107 mol·L-1。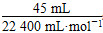 ≈0.002 01 mol,
≈0.002 01 mol,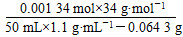 ×100%≈0.083%。
×100%≈0.083%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题

| A.2.5 μmol·L-1·min-1和2.0 μmol·L-1 |
| B.2.5 μmol·L-1·min-1和2.5 μmol·L-1 |
| C.3.0 μmol·L-1·min-1和3.0 μmol·L-1 |
| D.5.0 μmol·L-1·min-1和3.0 μmol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
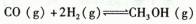

| A.反应达平衡后,升高温度,平衡常数K增大。 |
| B.反应过程中使用Cu2O/ZnO作催化剂,二者均不参加反应。 |
C.500℃反应达到平衡时,用氢气物质的量浓度减少表示该反应的反应速率是: |
| D.300℃反应达到平衡后,若其他条件不变,将体积缩小到原来的1/2,平衡右移,氢气物质的量浓度增大。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:| t/s c/(mol·L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol·L-1) | 0.100 | a | 0.5b | 0.4b | | |
| c(NO2)/(mol·L-1) | 0 | 0.060 | b | c1 | c2 | c3 |
 H4SiO4(aq) ΔH
H4SiO4(aq) ΔH查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.在溶液中存在化学平衡I2(aq) + I-(aq)  I3-(aq),其平衡常数表达式为 I3-(aq),其平衡常数表达式为 |
| B.第2组实验进行18s后,由于I2(g)不断生成导致I3-浓度下降。 |
| C.3-18s内第2组实验中生成I3-的平均反应速率约为0.55 mol/(L·s) |
| D.Fe2+可作为O3氧化I-的催化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.=0.15 mol/(L·s) ②v | B.=0.6 mol/(L·s) ③v | C.=0.4 mol/(L·s) ④v | D.=0.45 mol/(L·s) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.前2s以N2O4的浓度变化表示的平均反应速率为0.01mol·L-1·s-1 |
| B.在2s时体系内压强为开始时的1.1倍 |
| C.在平衡时体系内含有N2O40.25mol |
| D.平衡时,N2O4的转化率为40% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 O2(g)
O2(g) SO3(g) ΔH=-98 kJ/mol。某温度下,向一体积为2 L的密闭容器中充入0.2 mol SO2和0.1 mol O2,5 min后达到平衡,共放出热量11.76 kJ,下列说法正确的是( )
SO3(g) ΔH=-98 kJ/mol。某温度下,向一体积为2 L的密闭容器中充入0.2 mol SO2和0.1 mol O2,5 min后达到平衡,共放出热量11.76 kJ,下列说法正确的是( )| A.5 min内用O2表示的反应速率为0.12 mol/(L·min) |
| B.该反应的平衡常数数值为7.5 |
| C.SO2的平衡转化率为60% |
| D.加入催化剂,可使ΔH变小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.48s | B.40s | C.20s | D.15s |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com