
| A. | CH4分子的比例模型: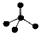 | B. | 氯原子的结构示意图: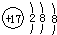 | ||
| C. | 乙烯的结构简式 CH2CH2 | D. | CS2结构式:S=C=S |
分析 A.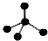 为甲烷的球棍模型,比例模型能够直观的看出甲烷分子中各原子的原子半径大小及空间构型;
为甲烷的球棍模型,比例模型能够直观的看出甲烷分子中各原子的原子半径大小及空间构型;
B.氯原子核电荷数、核外电子总数都是17,最外层电子数为7;
C.乙烯的结构简式中漏掉了碳碳双键;
D.二硫化碳与二氧化碳的结构相似,分子中存在两个碳硫双键.
解答 解:A.甲烷为正四面体结构,甲烷正确的比例模型为: ,故A错误;
,故A错误;
B.氯原子最外层电子数为7,氯原子正确的结构示意图为: ,故B错误;
,故B错误;
C.乙烯分子中含有碳碳双键,其正确的结构简式为:CH2=CH2,故C错误;
D.二硫化碳为直线型结构,分子中存在两个碳硫双键,其结构式为:S=C=S,故D正确;
故选D.
点评 本题考查了比例模型与球棍模型、电子式、结构式、原子结构示意图的表示方法,题目难度中等,注意掌握常见的化学用语的概念及正确的表示方法,明确比例模型与球棍模型的区别,试题培养了学生规范答题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
 绿茶中含有物质EGCG具有抗癌作用,能使癌细胞自杀性死亡其结构见图.下列有关EGCG的说法中正确的是( )
绿茶中含有物质EGCG具有抗癌作用,能使癌细胞自杀性死亡其结构见图.下列有关EGCG的说法中正确的是( )| A. | EGCG易被氧化 | |
| B. | EGCG的分子中有1个手性碳原子 | |
| C. | 1mol EGCG与浓溴水发生取代反应时最多消耗6molBr2 | |
| D. | 1mol EGCG与氢氧化钠溶液反应最多消耗10molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图所示装置进行有关实验.
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图所示装置进行有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
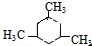 .
.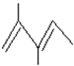 .
.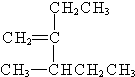 3-甲基-2-乙基-1-戊烯;
3-甲基-2-乙基-1-戊烯; 2,2,6-三甲基-4-乙基辛烷.
2,2,6-三甲基-4-乙基辛烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量的乙炔和苯完全燃烧生成二氧化碳的质量完全相等 | |
| B. | 都容易发生取代反应 | |
| C. | 苯只能在特殊条件下发生加成反应 | |
| D. | 苯不能被KmnO4所氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com