
| A. | 达到化学平衡时,n(CO2):n(NH3)=1:1 | |
| B. | 达到化学平衡时,n(CO2):n(H20)=1:1 | |
| C. | 达到化学平衡时,n[CO(NH2)2]:n(H20)=1:1 | |
| D. | 达到化学平衡时,n(NH3):n(H20)=1:1 |
分析 设起始时,n(CO2)=5mol,n(NH3)=1mol,则参加反应的氨气为0.2mol,根据方程式计算平衡时各组分物质的量.
解答 解:设起始时,n(CO2)=5mol,n(NH3)=1mol,则参加反应的氨气为1mol×20%=0.2mol,则:
CO2(g)+2NH3(g)=H2O(g)+CO(NH2)2(s)
起始量(mol):5 1 0 0
变化量(mol):0.1 0.2 0.1 0.1
平衡量(mol):4.9 0.8 0.1 0.1
A.达到化学平衡时,n(CO2):n(NH3)4.9:0.8=49:8,故A错误;
B.达到化学平衡时,n(CO2):n(H2O)=4.9:0.1=49:10,故B错误;
C.达到化学平衡时,n[CO(NH2)2]:n(H2O)=0.1:0.1=1:1,故C正确;
D.达到化学平衡时,n(NH3):n(H2O)=0.8:0.1=8:1,故D错误,
故选:C.
点评 本题考查化学平衡有关计算,比较基础,掌握三段式解题法在化学平衡计算中应用,有利于基础知识的巩固.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
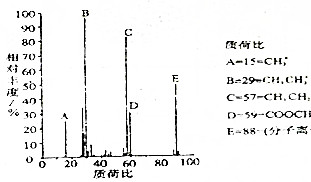 某有机物A的最简式为C2H4O,其质谱图如图所示:有机物A的质谱图和主要碎片的归属
某有机物A的最简式为C2H4O,其质谱图如图所示:有机物A的质谱图和主要碎片的归属查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ | |
| C. | 反应至4min时,若HCl的浓度为0.12mol•L-1,则H2的反应速率为:0.015mol/(L•min) | |
| D. | 当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol•L-1的NaOH溶液恰好反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
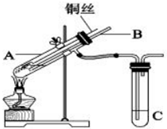 (1)用铜与浓硫酸反应制取硫酸铜,实验装置如图所示.
(1)用铜与浓硫酸反应制取硫酸铜,实验装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向逆反应方向移动 | B. | x+y<z | ||
| C. | C的体积分数降低 | D. | B的转化率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | 物质A的转化率变大 | ||
| C. | 物质B的质量分数增加 | D. | a>b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com