
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
科目:高中化学 来源: 题型:选择题
| A. | 溶液中的OH-向负极移动 | |
| B. | 在银表面上的反应为:Ag2S+2e-═2Ag+S2- | |
| C. | 在铝表面的反应为:Al-3e-═Al3+ | |
| D. | 在铝表面的反应为:Al+4OH--3e-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 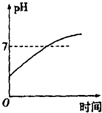 | B. | 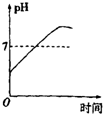 | C. | 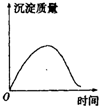 | D. | 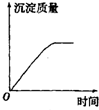 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
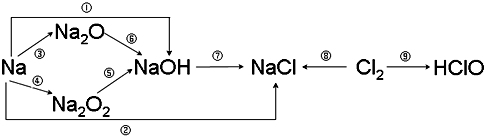
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
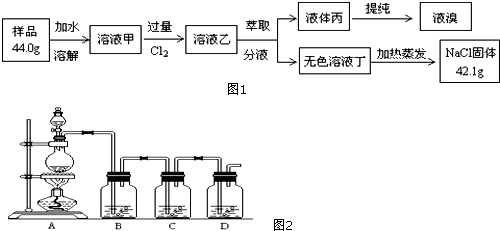
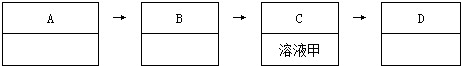
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
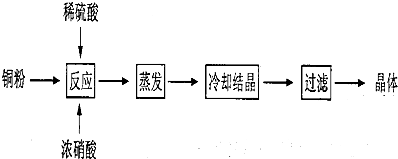
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 断开1mol H-H键和1 mol I-I键所需能量大于断开2mol H-I键所需能量 | |
| C. | 断开2mol H-I键所需能量约为(c+b+a)kJ | |
| D. | 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2akJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com