
某稀溶液中含4mol KNO3和2.5mol H2SO4,向其中加入1.5mol铁,充分反应后产生的NO气体在标准状况下的体积为( )
|
| A. | 36L | B. | 22.4L | C. | 28L | D. | 11.2L |
| 氧化还原反应的计算;化学方程式的有关计算.. | |
| 专题: | 计算题. |
| 分析: | n(H+)=2.5mol×2=5mol,n(NO3﹣)=4,发生3Fe+2NO3﹣+8H+=3Fe2++2NO↑+4H2O或Fe+NO3﹣+4H+=Fe3++NO↑+2H2O,铁粉的物质的量为1.5mol,由离子方程式判断过量,以此计算该题. |
| 解答: | 解:n(H+)=2.5mol×2=5mol,n(NO3﹣)=4,铁粉的物质的量为1.5mol, 由 3Fe+2NO3﹣+8H+=3Fe2++2NO↑+4H2O, 3 2 8 1.5mol 0.1mol 4mol, 则1.5molFe完全反应时,硝酸根离子与氢离子均过量, 则发生Fe+NO3﹣+4H+=Fe3++NO↑+2H2O, 若1.5molFe完全反应时,氢离子不足,则两个反应均发生, Fe+NO3﹣+4H+=Fe3++NO↑+2H2O x 4x x 3Fe+2NO3﹣+8H+=3Fe2++2NO↑+4H2O y 则 生成NO的体积为(0.75mol+0.75mol× 故选C. |
| 点评: | 本题考查氧化还原反应的计算,为高频考点,把握反应中电子守恒为解答的关键,注意过量判断及发生的反应判断,侧重分析与计算能力的考查,题目难度不大. |


科目:高中化学 来源: 题型:
NOx是汽车尾气中的主要污染物之一。
(1) NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_ .
(2)汽车发动机工作时会引发N2和02反应,其能量变化示意图如下:
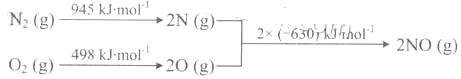
①写出该反应的热化学方程式: _ .
②随温度升高,该反应化学平衡常数的变化趋势是_ .。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放。
①当尾气中空气不足时,NOX在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:_ .
② 当尾气中空气过量时,催化转化器中的金属氧化物吸收NOX生成盐。其吸收能力顺序如下:12MgO <2oCaO <38SrO<56BaO.原因是 .
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
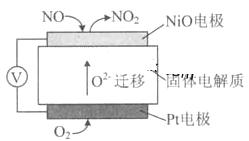
①Pt电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%。下列热化学方程式正确的是 ( )。
A.2SO3(g)  2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1
2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1
B.2SO2(g)+O2(g)  SO3(g) ΔH=-98.3 kJ·mol-1
SO3(g) ΔH=-98.3 kJ·mol-1
C.SO2(g)+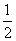 O2(g)
O2(g)  SO3(g) ΔH=+98.3 kJ·mol-1
SO3(g) ΔH=+98.3 kJ·mol-1
D.SO2(g)+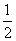 O2(g)
O2(g)  SO3(g) ΔH=-196.6 kJ·mol-1
SO3(g) ΔH=-196.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4═2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3═2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是( )
|
| A. | 两个反应中均为硫元素被氧化 |
|
| B. | 碘元素在反应①中被还原,在反应②中被氧化 |
|
| C. | 氧化性:Mn02>SO42﹣>I03﹣>I2 |
|
| D. | 反应①、②中生成等量的I2时转移电子数比为1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁均为中学化学常见的物质,它们之间的转化关系如图(反应条件及其它产物已略去).下列说法不正确的是( )

|
| A. | 若甲是AlCl3溶液,则丁可能是NaOH溶液 |
|
| B. | 若甲是Fe,则丁可能是Cl2 |
|
| C. | 若丁是CO2,则甲可能为Mg |
|
| D. | 若丁是O2,则乙、丙的相对分子质量可能相差16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室可用MnO2和KClO3混合加热的方法制取氧气:现有下列仪器或装置:
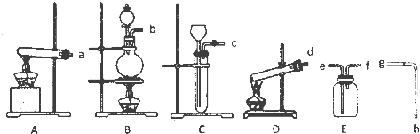
(1)A﹣D装置中,用作KClO3为原料制氧气的反应装置是 (填序号).
(2)排水法收集氧气,接口顺序是:氧气出口→ → →g→h→烧杯(填序号).
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1mol·L-1 NaHCO3溶液:K+、AlO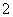 、Cl-、NO
、Cl-、NO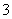
B.使甲基橙变红色的溶液:NH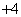 、Cu2+、ClO-、Na+
、Cu2+、ClO-、Na+
C.c(H+)=1×10-13 mol∙L-1的溶液中:Mg2+、Cu2+、SO42-、NO3-
D.遇苯酚变紫色的溶液:Na+、Mg2+、SO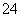 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
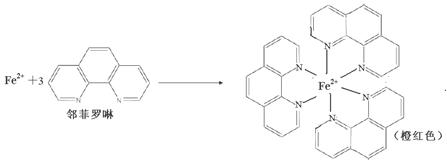
2K3[Fe(C2O4)3]═3K2CO3+Fe+FeO+4CO↑+5CO2↑元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值。
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:
4FeCl3+2NH2OH•HCl= 4FeCl2+N2O↑+6HCl+H2O
①Fe3+在基态时,核外电子排布式 ls22s22p63s23p63d6或[Ar]3d6 ;
②羟胺中(NH2OH)采用sp3杂化的原子有N、O ,三种元素电负性由大到小的顺
序为 ;
③Fe2+与邻啡罗啉(用A表示)形成的配合物[FeA3] 2+中,Fe2+的配位数为 6 ;
④N2O分子的空间构型为 (用文字描述)。
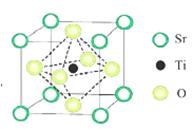 (2)分子氢的规模化制备是氢能应用的基础。在光化学电池中,以紫外线照钛酸锶电极时,可
(2)分子氢的规模化制备是氢能应用的基础。在光化学电池中,以紫外线照钛酸锶电极时,可
分解水制取H2同时获得O2。已知钛酸锶晶胞结构如
图所示,则钛酸锶的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com