
 NH4+(2)
NH4+(2)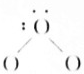 H2O(3)
H2O(3)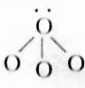 NH3
NH3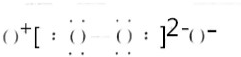 Na2O2(5)
Na2O2(5)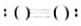 N2
N2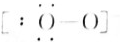 OH-(7)
OH-(7)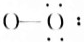 HF.
HF. 分析 中括号说明为离子,根据没有成键的电子数和成键电子数和推知原子的最外层电子数,根据原子序数小于11可知原子的种类,根据结构式可推知化学式.
解答 解:(1)铵根中N与H形成4条共价键,中括号说明为离子, 为NH4+,故答案为:NH4+;
为NH4+,故答案为:NH4+;
(2)H2O中O与H形成2条共价键,剩余2对孤对电对,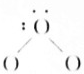 为H2O,故答案为:H2O;
为H2O,故答案为:H2O;
(3)氨气中N与H形成三条共价键,剩余一对孤对电对, 为NH3,故答案为:NH3;
为NH3,故答案为:NH3;
(4)Na2O2中两个氧原子间形成1条共价键,过氧根和钠离子间为离子键,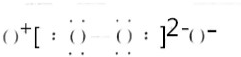 为Na2O2,故答案为:Na2O2;
为Na2O2,故答案为:Na2O2;
(5)N2中N原子间形成三条共价键,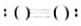 为N2,故答案为:N2;
为N2,故答案为:N2;
(6)OH-中N与H形成1条共价键,中括号说明为离子,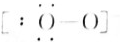 为OH-,故答案为:OH-;
为OH-,故答案为:OH-;
(7)HF中F与H形成1条共价键,剩余3对孤对电对,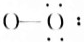 为HF,故答案为:HF.
为HF,故答案为:HF.
点评 本题考查了常见元素的成键特点,题目难度不大,注意把握原子形成的共价键数目与其原子核外的单电子数有关.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠和钾合金具有导电性,可用作快中子反应堆热交换剂 | |
| B. | 明矾溶于水后能产生Al(OH)3胶体,可用作净水剂 | |
| C. | 水玻璃(Na2SiO3)易溶于水,可用作防火剂 | |
| D. | 浓硫酸具有脱水性,可用于干燥氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
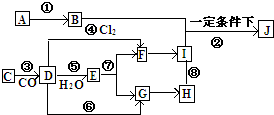 A→J有如图所示的转化关系(反应条件、部分反应物和产物已忽略):其中A、D为银白色金属单质;B为淡黄色粉末,C为红棕色粉末,E为黑色晶体;H久置于空气中,由白色固体变为灰绿色,最终变成红褐色Ⅰ;B和I在一定条件下反应生成J,J的化学式为Na2FeO4,它能够杀菌消毒,是一种优良的净水剂.
A→J有如图所示的转化关系(反应条件、部分反应物和产物已忽略):其中A、D为银白色金属单质;B为淡黄色粉末,C为红棕色粉末,E为黑色晶体;H久置于空气中,由白色固体变为灰绿色,最终变成红褐色Ⅰ;B和I在一定条件下反应生成J,J的化学式为Na2FeO4,它能够杀菌消毒,是一种优良的净水剂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.0 | - | - | - |
| 沉淀完全是的pH | 3.7 | 9.0 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
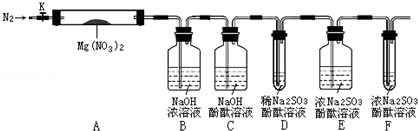
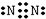 ,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.
,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com