
| A. | 1 mol Fe与过量的稀HNO3反应,转移2 NA个电子 | |
| B. | 常温常压下,22.4L的NO2和CO2合气体含有2 NA个O 原子 | |
| C. | 1 L 0.1 mol•L-1NaHCO3液含有0.1 NA个HCO3- | |
| D. | 常温下,4gCH4含有NA个C-H共价键 |
分析 A.Fe与过量的稀HNO3反应生成三价铁;
B.常温常压下,Vm≠22.4L/mol;
C.碳酸氢根离子存在电离和水解;
D.4g甲烷的物质的量为0.25mol,含有1mol碳氢键.
解答 解:A.1 mol Fe与过量的稀HNO3反应生成硝酸铁,转移3 NA个电子,故A错误;
B.常温常亚气体摩尔体积未知无法计算气体的物质的量,故B错误;
C.碳酸氢根离子存在电离和水解,所以1 L 0.1 mol•L-1NaHCO3液含有少于0.1 NA个HCO3-,故C错误;
D.常温下,4g甲烷的物质的量为0.25mol,0.25mol甲烷中含有1mol碳氢键,含有NA个C-H共价键,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,题目难度不大.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:解答题
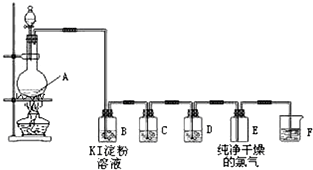
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol•L-1的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol•L-1的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=-867 kJ•mol-1 | |
| B. | CH4催化还原NOx为N2的过程中,若x=1.6,则转移电子3.2 mol | |
| C. | 若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移电子3.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
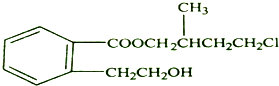
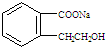 .
.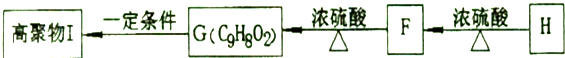
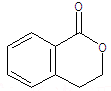 .②由F生成的G化学方程式
.②由F生成的G化学方程式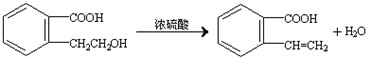 .
.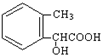 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com