
【题目】S16O2与18O2在高温条件下发生反应2SO2+O2![]() 2SO3,达到化学平衡后,平衡混合物中含18O的微粒( )
2SO3,达到化学平衡后,平衡混合物中含18O的微粒( )
A. 只有SO3 B. 只有SO2、SO3 C. 有SO2、SO3、O2 D. 只有O2、SO3
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】异丙烯苯和异丙苯是重要的化工原料,二者存在如图转化关系:

下列说法正确的是
A. 异丙烯苯分子中所有碳原子一定共平面
B. 异丙烯苯和乙苯是同系物
C. 异丙苯与足量氢气完全加成所得产物的一氯代物有6种
D. 0.05mol异丙苯完全燃烧消耗氧气13.44L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为2CH3OH+3O2+4KOH==2K2CO3+6H2O。下列说法正确的是( )

A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应为CH3OH - 6e- +2H2O=CO32- +8H+
C.甲池中消耗280mL(标准状况下)O2,此时乙池中银极增重1.6g
D.反应一段时间后,向丙池中加入一定量盐酸,一定能使NaCl溶液恢复到原浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时都会引起( )
A. CH3COOH电离程度变大 B. 溶液pH减小 C. 溶液的导电能力减弱 D. 溶液中c(H+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关盐类水解的说法中,不正确的是( )。
A. 盐类的水解过程破坏了纯水的电离平衡
B. 盐类的水解是酸碱中和反应的逆反应
C. 盐类水解后的溶液不一定显中性
D. ![]() 溶液中,
溶液中, ![]() 是
是![]() 的两倍
的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴有BaCl2和KCl的混合溶液V L,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗a mol H2SO4;另一份滴加AgNO3溶液,消耗b mol AgNO3使Cl-完全沉淀。原混合溶液中的K+的物质的量浓度为______mol/L。
⑵下列微粒:①S ②SO32- ③ Fe2+ ④Al3+ ⑤Na ⑥HCl ⑦Na2O2在化学反应中只能被氧化的是______![]() 填序号
填序号![]() ,只能表现出氧化性的是______
,只能表现出氧化性的是______![]() 填序号
填序号![]() 。
。
⑶一定条件下, PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为______mol;
⑷在一定条件下,实验室分别以过氧化氢、高锰酸钾、氯酸钾、过氧化钠为原料制取氧气,当制得同温同压下相同体积的氧气时,四个反应中转移的电子数之比为______。
⑸自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用Al粉还原NO3-,产物是N2发生的反应可表示如下,请完成方程式的配平。____Al + ____NO3-+ ________ == ____AlO2- + ____N2↑ +____ H2O,
⑹某化学反应的反应物和产物:![]()
①该反应的氧化产物是______。
②若该反应方程式中I2和KIO3的计量数分别是6和3,请在下边的化学式上用单线桥标出电子转移的方向和数目:KMnO4 + KI + H2SO4→______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12.某溶液中含有Cl-、Br-和CrO42-浓度均为0.010mol.L-1,向该溶液中逐滴加入0.010mol.L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Cl-、Br-、CrO42- B. CrO42-、Br-、Cl-
C. Br-、Cl-、CrO42- D. Br-、CrO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg、Al、Fe 三种金属的混合物与足量的稀硫酸反应,生成 2.8L H2(标准状况)则三种金属的物 质的量之和不可能是( )
A.0.12 molB.0.15 molC.0.09 molD.0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粮食仓储常用磷化铝(AlP)熏蒸杀虫,AlP遇水即产生强还原性的PH3气体。国家标准规定粮食中磷化物(以PH3计)的残留量不超过0.05mg·kg-1时为合格。某小组同学用图所示实验装置和原理测定某粮食样品中磷化物的残留量。C中加入100g原粮,E中加入20.00mL 2.50×10-4mol·L-1KMnO4溶液(H2SO4酸化),C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中的溶液。
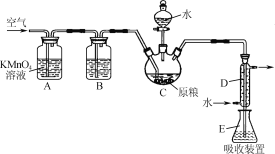
(1)装置A中的KMnO4溶液的作用是________。
(2)装置B中盛装焦性没食子酸的碱性溶液吸收空气中的O2。若去掉该装置,则测得的磷化物的残留量________(填“偏高”“偏低”或“不变”)。
(3)装置E中PH3被氧化成磷酸,MnO4-被还原为Mn2+,写出该反应的离子方程式:________。
(4)收集装置E中的吸收液,加水稀释至250mL,量取其中的25.00mL于锥形瓶中,用4.0×10-5 mol·L-1的Na2SO3标准溶液滴定,消耗Na2SO3标准溶液20.00 mL,反应原理是SO32-+MnO4-+H+→SO42-+Mn2++H2O(未配平)。通过计算判断该样品是否合格(写出计算过程)。_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com