
【题目】下列除杂方案错误的是( )
选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
A | C2H5OH(l) | H2O(l) | 新制的生石灰 | 蒸馏 |
B | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
C | Cl2(g) | HCl(g) | 饱和食盐水、浓H2SO4 | 洗气 |
D | NaCl(s) | Na2CO3(s) | 盐酸 | 蒸发 结晶 |
A.A
B.B
C.C
D.D
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() 的系统命名法为2, 5-二甲基-4乙基己烷
的系统命名法为2, 5-二甲基-4乙基己烷
B.石油的裂化、煤的气化与液化都属于化学变化,而石油的分馏与煤的干馏都属于物理变化
C.总质量一定时,乙酸和葡萄糖无论以何种比例混合,完全燃烧消耗氧气的量相等
D.可用石蕊落液来鉴别乙二醇、葡萄糖、乙酸的水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)写出下列有机物的键线式: 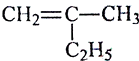
(2)写出有机物  的名称
的名称
(3)写出甲基电子式: , 乙炔的结构式
(4)某有机高分子化合物的结构片段如下:
则合成它的单体是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某酸H2B 在水溶液中存在下列关系:H2B=H++HB-,HB-![]() H++B2- 。则下列关于酸式盐NaHB 溶液的说法中正确的是
H++B2- 。则下列关于酸式盐NaHB 溶液的说法中正确的是
A. 电离方程式:NaHB=Na++H++B2-
B. NaHB 溶液可能呈酸性或碱性
C. NaHB 和NaOH 溶液反应的离子方程式:HB-+OH-= H2O+B2-
D. 该溶液中:c(Na+)=c(H2B)+c(HB-)+c(B2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,有两种溶液:①0.01 mol·L-1 NH3·H2O溶液、②0.01 mol·L-1 NH4Cl溶液,下列操作可以使两种溶液中c(NH4+)都增大的是
A.通入少量HCl气体 B.加入少量NaOH固体
C.加入少量H2O D.适当升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华文化源远流长、博大精深。从化学的视角看,下列理解不正确的是
A | B | C | D |
千淘万漉虽辛苦,吹尽黄沙始到金。刘禹锡《浪淘沙》诗句 |
司母戊鼎 |
侯德榜 |
瓷器(China) |
诗句中“淘”“漉”相当于分离提纯操作中的“过滤”。 | 属青铜制品,是我国古代科技光辉成就的代表之一。 | 我国化学工业的奠基人,主要成就: 侯氏制碱法,该碱指的是烧碱。 | 属硅酸盐产品,China一词又指“瓷器”,这反映了在西方人眼中中国作为“瓷器故乡”的形象。 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在一定体积pH = 12的NaOH溶液中, 加入一定体积0.01 mol/L的NaHSO4溶液,此时混合溶液的pH = 11。若反应后溶液的体积等于NaOH 溶液与NaHSO4溶液的体积之和,则NaOH溶液与NaHSO4溶液的体积比是( )
A. 1∶9 B. 10∶1 C. 11∶9 D. 1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面说法中,与盐类水解无关的是( )
①NaHCO3做发酵粉时加入柠檬酸后效果更好
②FeCl2溶液中加入一定量的铁粉
③实验室配制AlCl3溶液,先把它溶解在盐酸中,而后加水稀释
④NH4F溶液不能保存在玻璃试剂瓶中
⑤实验室盛放Na2CO3、Na2SiO3 等溶液的试剂瓶应用橡皮塞
⑥在NH4Cl或AlCl3 溶液中加入镁条会产生气泡
⑦Na2S溶液和AlCl3溶液反应得不到Al2S3
⑧室温下NaHCO3饱和溶液pH约为8.4
⑨0.1 mol/L AlCl3溶液中c(Al3+)<0.1 mol/L
A. ②⑧ B. ①② C. ④⑧ D. 全有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)以天然气为原料制H2是合成氨的一条重要的路线。甲烷的部分氧化可得到合成氨的原料气H2,其反应式如下:①CH![]() (g)+1/2O
(g)+1/2O![]() (g)══CO(g)+2H
(g)══CO(g)+2H![]() (g) ΔH1=-35.6kJ·mol
(g) ΔH1=-35.6kJ·mol![]() ,试判断常温下,上述反应能否自发进行:___________(填”能”或”否”)。
,试判断常温下,上述反应能否自发进行:___________(填”能”或”否”)。
有研究认为甲烷部分氧化的机理为:
②CH![]() (g)+2O
(g)+2O![]() (g)=CO2(g)+2H2O(g) ΔH2=-890.3kJ·mol
(g)=CO2(g)+2H2O(g) ΔH2=-890.3kJ·mol![]() ;
;
③CH![]() (g)+CO
(g)+CO![]() (g)=2CO(g)+2H
(g)=2CO(g)+2H![]() (g) ΔH3=+247.3kJ·mol
(g) ΔH3=+247.3kJ·mol![]() ,请结合以上三个反应与条件写出CH4和H2O(g)生成CO和H2的热化学反应方程式:________________________________。
,请结合以上三个反应与条件写出CH4和H2O(g)生成CO和H2的热化学反应方程式:________________________________。
(2)恒温下,向一个2L的密闭容器中充入1 mol N2和2.6 molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/( mol ·/L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
此条件下,该反应达到化学平衡时,氮气的浓度为_______________。
(3)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
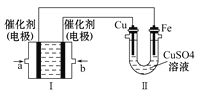
①b处电极上发生的电极反应式是_____________________________。
②电镀结束后,装置Ⅰ中溶液的pH___________(填写“变大”、“变小”或“不变”,下同),装置Ⅱ中Cu![]() 的物质的量浓度___________________。
的物质的量浓度___________________。
③若完全反应后,装置Ⅱ中阴极质量增加12.8g,则装置Ⅰ中理论上消耗甲烷_________L (标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com