

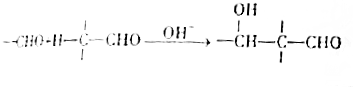
 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$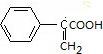 +Cu2O+2H2O
+Cu2O+2H2O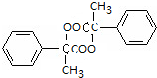
分析 合物X在氧气中完全燃烧生成17.6g二氧化碳即0.4mol和3.6gH2O即0.2mol,所以X中碳、氢个数比为1:1,最大的质荷比为120,即相对分子质量为120,且X能发生银镜反应,即有醛基,苯环上的一氯代物有3种,则X为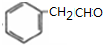 ,
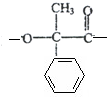
, 与甲醛发生信息中的加成反应得A为
与甲醛发生信息中的加成反应得A为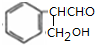 ,A脱水得B为
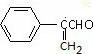
,A脱水得B为 ,B发生氧化反应得C为
,B发生氧化反应得C为 ,C与溴化氢加成得D为
,C与溴化氢加成得D为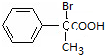 ,D水解得E为
,D水解得E为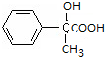 ,D在浓硫酸条件下加热得含有三个六元环的F为
,D在浓硫酸条件下加热得含有三个六元环的F为 ,D发生缩聚反应得G为
,D发生缩聚反应得G为 ,据此答题;
,据此答题;
解答 解:合物X在氧气中完全燃烧生成17.6g二氧化碳即0.4mol和3.6gH2O即0.2mol,所以X中碳、氢个数比为1:1,最大的质荷比为120,即相对分子质量为120,且X能发生银镜反应,即有醛基,苯环上的一氯代物有3种,则X为 ,
, 与甲醛发生信息中的加成反应得A为
与甲醛发生信息中的加成反应得A为 ,A脱水得B为
,A脱水得B为 ,B发生氧化反应得C为
,B发生氧化反应得C为 ,C与溴化氢加成得D为
,C与溴化氢加成得D为 ,D水解得E为
,D水解得E为 ,D在浓硫酸条件下加热得含有三个六元环的F为
,D在浓硫酸条件下加热得含有三个六元环的F为 ,D发生缩聚反应得G为
,D发生缩聚反应得G为 ,
,
(1)X为 ,X的分子式为C8H8O,D为
,X的分子式为C8H8O,D为 ,D中官能团的名称为溴原子和羧基,
,D中官能团的名称为溴原子和羧基,
故答案为:C8H8O;溴原子和羧基;
(2)根据上面的分析可知,由E生成G的反应类型为缩聚反应,G的链节为 ,
,
故答案为:缩聚反应; ;
;
(3)由B生成C反应①的化学方程式为  +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O+2H2O,
+Cu2O+2H2O,
故答案为: +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O+2H2O;
+Cu2O+2H2O;
(4)由D到E的反应为水解反应,所以条件为氢氧化钠溶液、加热,F的结构简式为  ,
,
故答案为:氢氧化钠溶液、加热; ;
;
(5)A为 ,根据条件①含有苯环,且苯环上只有一个支链,②能与NaOH溶液反应,即含有羧基或酯基,则的符合条件的A的分异构体为苯环上连有-CH2CH2COOH,或-CH(CH3)COOH,或-CH(CH3)OOCH,或-CH2CH2OOCH,或-CH2OOCCH3,或-OOCCH2CH3,所以共有6种,
,根据条件①含有苯环,且苯环上只有一个支链,②能与NaOH溶液反应,即含有羧基或酯基,则的符合条件的A的分异构体为苯环上连有-CH2CH2COOH,或-CH(CH3)COOH,或-CH(CH3)OOCH,或-CH2CH2OOCH,或-CH2OOCCH3,或-OOCCH2CH3,所以共有6种,
故答案为:6.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断以及知识综合应用能力,正确判断A结构简式是解本题关键,再结合反应条件、生成物分子式或结构特点进行推断,难点是同分异构体判断,题目难度中等.


科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 甲 | 乙 |
| 分子式 | C2H6O2 | C3H8O3 |
| 熔点/℃ | -11.5 | 17.9 |
| 沸点/℃ | 198 | 290 |
| 密度/g•cm-3 | 1.11 | 1.26 |
| 溶解性 | 易溶于水和酒精 | 易溶于水和酒精 |
| A. | 萃取法 | B. | 升华法 | C. | 蒸馏法 | D. | 分液法 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | K+、CO32-、Na+、SO42- | B. | NH4+、NO3-、Ba2+、Cl- | ||
| C. | Na+、MnO4-、NO3-、K+ | D. | Na+、SO42-、Mg2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液 | B. | Ca(OH)2悬浊液 | C. | Fe(OH)3胶体 | D. | 油漆等乳浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的NaHS溶液中:c(OH-)=c(H+)+c(H2S) | |
| B. | 往氯化铵溶液中加水$\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$的值变大 | |
| C. | 0.1mol•L-1的NaOH溶液与0.2mol•L-1的HA溶液等体积混合,所得溶液呈现碱性:c(Na+)>c(HA)c(A-)>c(OH-)>c(H+) | |
| D. | pH相等的①NH4Cl②NH4Al(SO4)2③NH4HSO4溶液中,c(NH4+)大小顺序:①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铝片插入硝酸铜溶液中:Cu2++Al=Al3++Cu | |
| B. | 盐酸与饱和的澄清石灰水反应:H++OH-══H2O | |
| C. | 碳酸钙与醋酸反应:CaCO3+2H+══Ca2++CO2↑+H2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M溶液的pH>7 | |
| B. | 25℃时,溶度积常数Ka[NH3•H2O]约为1X10-7 | |
| C. | 25℃时,向M溶液中加少量盐酸,$\frac{c(N{H}_{4}^{+})}{(N{H}_{3}•{H}_{2}O)•c({H}^{+})}$的比值变小 | |
| D. | 25℃时,向1L0.2mol•L-1NH3•H2O溶液中加入1L0.2mol•L-1MgCl溶液,有Mg(OH)2沉淀产生(混合后溶液的体积变化不计) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com