
 下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中正确的是
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中正确的是
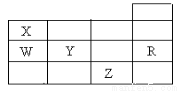
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物比X的氢化物稳定
D.Y元素最高价氧化物对应水化物比W元素的最高价氧化物对应水化物的酸性强
D
【解析】
试题分析: 根据五种元素在周期表中的位置可知,X为N元素,W为P元素,Y为S元素,Z为Br元素,R为Ar元素,则A.Y为S元素,Z为Br元素,常压下S固体,而Br为液体,所以常压下,Y单质的沸点比Z单质的沸点高,故A错误;B. Y的阴离子核外有18个电子,与R原子相同,Z的阴离子核外有36个电子,与R得电子层结构不相同,故B错误;c. 同主族自上而下,非金属性减弱,所以非金属性X>W,非金属性越强,氢化物越稳定,所以氢化物的稳定性W<X,故c错误;D.同周期元素从左到右,非金属性逐渐增强,所以非金属性Y>W,则Y元素最高价氧化物对应水化物的酸性比W元素的最高价氧化物对应水化物的酸性强,故D正确.
故选D.
考点:考查元素位置与元素性质,结构关系的相关知识点。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:简答题
(12分)W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示。常温下0.01mol/L-1丙溶液
PH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图II所示。请回答下列问题:
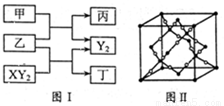
(1)甲与乙反应的化学方程式是______。
(2)甲的中心原子杂化轨道类型为_____;
XY2分子中,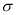 键与π键的数目之比为_________;
键与π键的数目之比为_________;
XY2原子晶体的1个晶胞中含有_______个原子。
W、X、Y、Z四种元素电负性由大到小的顺序是_______(用元素符号表示)。
工业上用氯气与潮湿的丁反应制备次氯酸的酸酐(棕黄色气体),同时生成小苏打和食盐混合物,反应的化学方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省眉山市高三第二次诊断性考试理综化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.水玻璃长时间放置在空气中:SiO32-+CO2+H2O=H2SiO3↓+HCO3-
B.硫酸铜溶液显酸性:Cu2++2H2O=Cu(OH)2↓+2H+
C.用石墨电极电解饱和食盐水:2H++2Cl-  H2↑+Cl2↑
H2↑+Cl2↑
D.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:
Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省攀枝花市高一(下)学期调研检测化学试卷(解析版) 题型:填空题
按要求回答下列问题:
(1)硫酸铜水溶液中含有的水合铜离子化学式为________。向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液,生成深蓝色的配合离子化学式为________ ,再向反应后的溶液中加入乙醇,析出的深蓝色晶体的化学式为________ 。
(2)试比较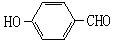 和
和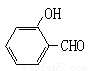 的沸点高低并说明理由_________。
的沸点高低并说明理由_________。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省攀枝花市高一(下)学期调研检测化学试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是
A.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H+十SO42-== BaSO4↓+H2O
B.稀碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3- + OH- == CO32- + H2O
C.氯化铝溶液中滴加过量氨水:Al3+ + 3NH3·H2O== Al(OH)3↓+ 3NH4+
D.常温下,将铜片加入稀硝酸中:Cu + 2H+ == Cu2+ + 2H2↑
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省成都市高第二期期末高一化学试卷(解析版) 题型:实验题
树德中学某化学兴趣小组在实验室用MnO2与浓盐酸反应制备C12(发生装置如图所示)。
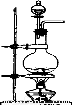
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是 序号)。
A.往烧瓶中加入浓盐酸
B.加热
C.往烧瓶中加入MnO2粉末
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,兴趣小组同学提出下列实验探究方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量
乙方案:采用酸碱恰好中和(有指示剂)的方法测定
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量
丁方案:与足量Zn反应,测量生成的H2体积(换算为标准状况)
继而进行下列判断和实验:
①判定甲方案是否可行 (填“是”或“否”),理由是 。
②进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,滴入0.200 0 mol/L的NaOH溶液,消耗NaOH溶液22.00 mL,该次测得试样中盐酸浓度为 mol·L一1;
b.重复以上操作多次取平均值获得实验结果
③判断丙方案的实验结果 (填“偏大"、“偏小”或“准确”)。
(已知:部分CaCO3会转化为更难溶的MnCO3)
④进行丁方案实验:装置如图所示(夹持器具已略去)
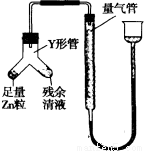
(i)使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。
(ii)反应完毕,每间隔l分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是 (排除仪器和实验操作的影响因素)
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省成都市五校高一下学期期中联考化学试卷(解析版) 题型:实验题
(15分)某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)试用实验室提供的下列试剂,设计两个原理不同的简单实验(只要写出实验的方案即可),证明镁元素的金属性比铝元素强。
试剂:镁条、铝条、氯化铝溶液、氯化镁溶液、稀盐酸、氢氧化钠溶液
方案一:_____________________________________________________________;
方案二:_____________________________________________________________。
Ⅱ.利用下图装置可验证同周期元素非金属性的变化规律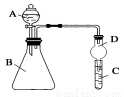
(1)仪器A的名称为________,干燥管D的作用为________________。
(2)若要证明非金属性:Cl>S,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加___________,观察到C中溶液___________________________的现象,即可证明。反应的离子方程式为________________________________________________________。
从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气。
(3)若要证明非金属性:N>C,则在A中加稀硝酸,B中加碳酸钙,C中加澄清石灰水;观察到C中溶液变浑浊的现象,即可证明。该实验原理为______________________________。但有的同学在实验中一切操作正确的情况下没观察到上述现像,试分析可能的原因是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com