
| A.元素最高化合价:Na<Mg<Al | B.元素非金属性:N>O>F |
| C.酸性:H3PO4<H2SO4<HClO4 | D.原子核外电子层数:Li<Na<K |
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源:不详 题型:单选题
| 加入溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI淀粉溶液 |
| 实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
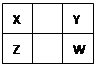
| A.Z元素的原子半径可能比Y元素的小 |
| B.Z元素的最高化合价可能比Y元素的高 |
| C.W的气态氢化物的稳定性一定比Y的强 |
| D.Z的最高价氧化物的水化物的酸性一定比W的强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X:3d64s2 Y:2s22p4 | B.X:2s22p3 Y:2s22p4 |
| C.X:3s23p1 Y:3s23p4 | D.X:3s2 Y:3s23p5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 周期元素,它们的原子结构或性质如下表所示:
周期元素,它们的原子结构或性质如下表所示:
 子式为 .
子式为 .查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
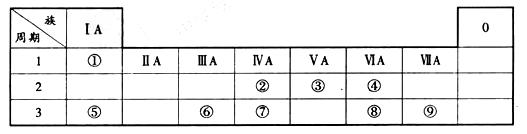
 、⑨两元素非金属性较强的是(写元素符号) ,举二个例子说明推
、⑨两元素非金属性较强的是(写元素符号) ,举二个例子说明推 断依据: 。
断依据: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.②③ | C.②④ | D.只有④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com