
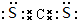 .
.分析 X、Y、Z、W、R是短周期元素,原子序数依次增大,Y的氧化物和R的氧化物均能形成酸雨,则Y为N元素、R为S元素;W和R是同周期相邻元素,则W为P元素;Y原子和Z原子的核外电子数之和为20,则Z原子核外电子数=20-7=13,则Z为Al;X原子核外各层电子数之比为1:2,X有2个电子层,可能为Li或C,由于只有一种金属,故X为C元素,以此解答该题.
解答 解:X、Y、Z、W、R是短周期元素,原子序数依次增大,Y的氧化物和R的氧化物均能形成酸雨,则Y为N元素、R为S元素;W和R是同周期相邻元素,则W为P元素;Y原子和Z原子的核外电子数之和为20,则Z原子核外电子数=20-7=13,则Z为Al;X原子核外各层电子数之比为1:2,X有2个电子层,可能为Li或C,由于只有一种金属,故X为C元素,
(1)W为P,原子核外有3个电子层,最外层电子数为5,则位于周期表第三周期第VA,CS2的电子式为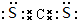 ,
,
故答案为:第三周期第VA;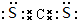 ;
;
(2)碳与浓硝酸在加热条件下反应生成二氧化碳、二氧化氮和水,方程式:C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,NH3分子间存在氢键,故氨气的沸点高于PH3的,
故答案为:C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;NH3;分子之间存在氢键;
(3)N和Al组成的化合物AlN,被大量用于制造电子元件.工业上用氧化铝、碳、氮气在高温下制备,其中氧化铝和碳的物质的量之比为1:3,说明还生成CO,则该反应的化学方程式为Al2O3+3C+N2$\frac{\underline{\;\;△\;\;}}{\;}$2AlN+3CO,故答案为:Al2O3+3C+N2$\frac{\underline{\;\;△\;\;}}{\;}$2AlN+3CO.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,熟练掌握原子结构与元素周期律、元素周期表的关系是解题关键,注意氢键对物质熔沸点影响,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 将过量CO2气体通入水玻璃中可制得硅酸和纯碱 | |
| B. | 标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移电子0.1 mol | |
| C. | 1 L 2 mol•L-1明矾经水解可得到氢氧化铝胶体粒子数目为2×6.02×1023 | |
| D. | 漂白粉溶于水能导电,故漂白粉是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过电解饱和食盐水可制得单质Na | |
| B. | 工业上常用H2还原MgO制得单质Mg | |
| C. | 通过加热分解HgO可制得单质Hg | |
| D. | 用铝热法还原MnO2和Fe2O3,制得金属各1mol,消耗铝较少的是MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
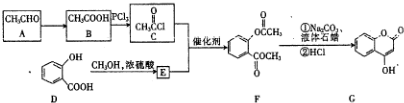
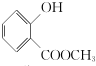 ,G中所含官能团的名称为酯基、碳碳双键、羟基;
,G中所含官能团的名称为酯基、碳碳双键、羟基;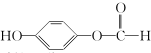 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s22s22p5 | B. | 1s22s22p43s2 | ||
| C. | 1s22s22p63s23p63d54s1 | D. | 1s22s22p63s23p63d34s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
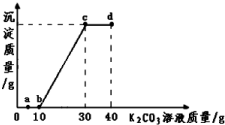
| A. | 向a点对应的溶液中滴加无色酚酞试液,溶液为无色 | |
| B. | 该温度下,K2CO3的溶解度为100g | |
| C. | 由图象可得,10g该溶液中氯化钙的质量约为8g | |
| D. | b、c、d三点对应的溶液中分别含有两种溶质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气 二氧化碳 氢氧化钠 | B. | 氯化钠 过氧化钠 氯化铵 | ||
| C. | 氯化钠 过氧化氢 氯化铵 | D. | 氯化钠 氦气 氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com