
【题目】A、B、C、D、E均为短周期元素,非金属元素A的最外层电子数与其周期数相等,B的成对电子与未成对电子所占据的原子轨道数相等。单质B在单质C中充分燃烧生成BC2。 D+与C2-具有相同的电子数。A在E中燃烧,产物溶于水会得到一种强酸。
(1)B在元素周期表中的位置是________,写出一种工业制备单质E的化学方程式:_____。
(2)B、C、D组成的一种盐中,B的质量分数为17. 91%,D的质量分数为34. 3 3%。该盐的化学式为________,其阴离子中B原子的杂化方式为__________。
(3)由这些元素组成的某些物质的组成和结构信息如下表:
物质 | 组成和结构 |
a | A、D两元素组成的离子化合物 |
b | 由C、D两元素组成的含有非极性键的离子化合物 |
c | 化学组成为BCE2 |
a的电子式为_________;b的化学式为________;c的空间构型为___________。
【答案】 第二周期IVA族 2NaCl(熔融)![]() 2Na+Cl2↑(或2NaCl+2H2O
2Na+Cl2↑(或2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑) Na2C2O4 sp2
2NaOH+Cl2↑+H2↑) Na2C2O4 sp2 ![]() Na2O2 平面三角形
Na2O2 平面三角形
【解析】A、B、C、D、E为短周期元素,非金属元素A最外层电子数与其周期数相同,则A为H元素;D+与C2-具有相同的电子数,则D处于IA族,C处于ⅥA族,则D为Na、C为O元素;B在C中充分燃烧生成其最高价化合物BC2,B的最高正化合价为+4,B的成对电子与未成对电子所占据的原子轨道数相等,则B处于第二周期,故B为碳元素;A在E中燃烧,产物溶于水得到种强酸,则E为Cl;
(1)B为碳元素,在元素周期表中的位置是:第二周期IVA族,工业通常电解饱和食盐水或熔融NaCl得到氯气,化学方程式为2NaCl(熔融)![]() 2Na+Cl2↑(或2NaCl+2H2O
2Na+Cl2↑(或2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑);
2NaOH+Cl2↑+H2↑);
(2)C、O、Na组成的一种盐中,C的质量分数为17. 91%,O的质量分数为34.33%,Na的质量分数为1-17. 91%-34.33%=47.76%;则Na、C、O的原子数目比为: ![]() ︰
︰![]() ︰
︰![]() =1:1:2,则该盐的化学式为Na2C2O4,在C2O42-离子中含有碳氧双键,共有3个σ键,则碳原子轨道的杂化类型为sp2杂化;
=1:1:2,则该盐的化学式为Na2C2O4,在C2O42-离子中含有碳氧双键,共有3个σ键,则碳原子轨道的杂化类型为sp2杂化;
(3)a由Na和H组成的离子化合物NaH,电子式为![]() ;Na与O两元素组成的含有非极性键的离子化合物为Na2O2;化学组成为BCE2的化学式为COCl2,其中碳原子为sp2杂化,则其空间构型为平面三角形。
;Na与O两元素组成的含有非极性键的离子化合物为Na2O2;化学组成为BCE2的化学式为COCl2,其中碳原子为sp2杂化,则其空间构型为平面三角形。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)![]() 2H2O(l) ΔH=571.6 kJ·mol1,CO(g)+
2H2O(l) ΔH=571.6 kJ·mol1,CO(g)+![]() O2(g)
O2(g)![]() CO2(g) ΔH=282.8 kJ·mol1,现有CO、H2和CO2组成的混合气体112.0 L(标准状况),经完全燃烧后放出的总热量为851.4 kJ,并生成18 g液态水。则燃烧前混合气体中CO的体积分数为
CO2(g) ΔH=282.8 kJ·mol1,现有CO、H2和CO2组成的混合气体112.0 L(标准状况),经完全燃烧后放出的总热量为851.4 kJ,并生成18 g液态水。则燃烧前混合气体中CO的体积分数为
A.80% B.40% C.60% D.20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行如下实验,能达到实验目的的是
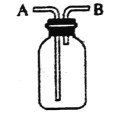
A. 瓶中盛满水,从B口进气,用排水法收集HCl气体
B. 瓶中盛适量浓硫酸,从A口进气来干燥NH3
C. 从B口进气,用排空气法收集CO2
D. 瓶中盛满水,A口连导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
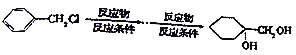
【题目】相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如图所示的关系图(部分产物、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
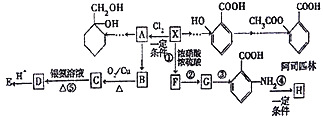
己知:
Ⅰ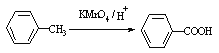 Ⅱ
Ⅱ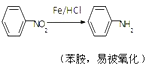
请根据所学知识与本题所给信息回答下列问题:
(1)H的结构简式是________________。
(2)反应②、③的反应类型分别是________________、________________。
(3)反应①的化学方程式是_________________________。反应⑤的化学方程式是___________________。
(4)![]() 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有______种。
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有______种。
(5)请用合成反应流程图表示出由![]() 和其他无机物合成
和其他无机物合成![]() 最合理的方案(不超过4步)。例如:
最合理的方案(不超过4步)。例如:
 ______________________________________________________________________________
______________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298 K时,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,推测含1 mol HCl的稀溶液与含1 mol NH3的稀溶液反应放出的热量 ( )
A. 大于57.3 kJ B. 等于57.3 kJ
C. 小于57.3 kJ D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学查阅资料获悉:用KMnO4可以测定H2O2的物质的量浓度:取15.00mL H2O2溶液,用稀H2SO4酸化;逐滴加入0.003mol·L-1KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至恰好完全反应时共消耗20.00 mL KMnO4溶液。该反应的离子方程式是:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O;
(1)该反应体现了H2O2的__________(填“氧化性”、“还原性”或“氧化性和还原性”);
(2)KMnO4溶液褪色速率开始较慢,后变快的原因可能是某种物质对该反应起到了催化作用,则该物质最有可能是________;(填序号) a. MnO4- b.H+ c.Mn2+ d.K+
(3)判断完全反应的现象是_________________________________________________;
(4)该H2O2溶液的物质的量浓度是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四组蛋白质中,可以在人体同一个细胞中产生的是( )
A. 胰高血糖素和胰蛋白酶 B. 抗体和干扰素
C. 溶菌酶和甲状腺激素受体 D. 生长激素和抗利尿激素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质焰色反应均为黄色,它们按图所示关系相互转化.
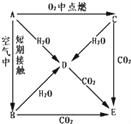
(1)这五种物质中,A: ___________、 C: ___________.
(2)将CO2通入E的饱和溶液中,该反应的离子方程式为______________________________.
(3)写出A→D、C→D、C→E反应的化学方程式
A→D:___________________________.
C→D:___________________________.
C→E:___________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com