
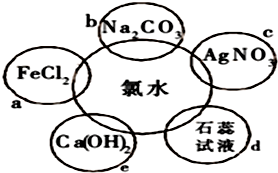
分析 氯水中存在反应Cl2+H2O=H++Cl-+HClO,溶液中存在Cl2、HClO、H+、Cl-等粒子,其中HClO不稳定,易分解,具有强氧化性和漂白性,
(1)氯气具有氧化性,可与氯化亚铁发生2Fe2++Cl2═2Fe3++2Cl-,因溶液呈酸性,可与碳酸钠发生2H++CO32-═H2O+CO2↑,溶液中含有氯离子,加入硝酸银可生成沉淀,反应的离子方程式为Ag++Cl-═AgCl↓,氯气和与氢氧化钙反应生成氯化钙和次氯酸钙,为制备漂白粉的主要反应,由此分析解答;
(2)氯气和水反应生成盐酸和次氯酸,其中盐酸可使石蕊变红,但生成的次氯酸具有漂白性;
(3)新制氯水中含有次氯酸,由于次氯酸不稳定,见光分解生成盐酸和氧气;
(4)因氯水中的次氯酸见光易分解,则保存时应避光、密闭保存;
(5)证明氯水与氯化亚铁反应生成铁离子,所需的试剂KSCN溶液.
解答 解:氯水中存在反应Cl2+H2O=H++Cl-+HClO,溶液中存在Cl2、HClO、H+、Cl-等粒子,
(1)氯气具有氧化性,可与氯化亚铁发生2Fe2++Cl2═2Fe3++2Cl-,因溶液呈酸性,可与碳酸钠发生2H++CO32-═H2O+CO2↑,溶液中含有氯离子,加入硝酸银可生成沉淀,反应的离子方程式为Ag++Cl-═AgCl↓,氯气和与氢氧化钙反应生成氯化钙和次氯酸钙,为制备漂白粉的主要反应,方程式为2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O,涉及氧化还原反应的为ae,
故答案为:2Fe2++Cl2═2Fe3++2Cl-、2H++CO32-═H2O+CO2↑、Ag++Cl-═AgCl↓;2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O;ae;
(2)氯气和水反应生成盐酸和次氯酸,其中盐酸可使石蕊变红,但生成的次氯酸具有漂白性,最终可使石蕊褪色,故答案为:氯水与石蕊试液反应,先变红后褪色;
(3)新制氯水中含有次氯酸,由于次氯酸不稳定,见光分解生成盐酸和氧气,发生2HClO$\frac{\underline{\;光\;}}{\;}$2HCl+O2↑,最终变为稀盐酸,
故答案为:稀盐酸;2HClO$\frac{\underline{\;光\;}}{\;}$2HCl+O2↑;
(4)因氯水中的次氯酸见光易分解,则保存时应避光、密闭保存,故答案为:在阴凉处置于棕色试剂瓶中密封保存;
(5)证明氯水与氯化亚铁反应生成铁离子,所需的试剂KSCN溶液,溶液变血红色证明反应发生,故答案为:KSCN溶液.
点评 本题综合考查氯气的性质,侧重于元素化合物知识的综合考查与运用,注意相关基础知识的积累,难度不大.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 用润湿的pH试纸测食盐水的pH,测定值偏小 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大 | |
| C. | 滴定前滴定管内无气泡,终点读数时有气泡,所取溶液体积偏小 | |
| D. | 中和滴定实验时,锥形瓶先用蒸馏水再用待测液润洗,所测溶液浓度偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质溶液中电子向正极移动 | |
| B. | 放电一段时间后,KOH的物质的量浓度不变 | |
| C. | 通乙烷的电极为负极 | |
| D. | 参加反应的O2和C2H6的物质的量之比为2:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①② | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IO3- | B. | MnO4- | C. | Cl2 | D. | HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、H2、N2 | B. | H2、N2、O2 | C. | CO2、Cl2、HCl | D. | SO2、O2、H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com