
分析 依据阿伏伽德罗定律:同温同压下,相同同体积的任何气体具有相同的分子数,结合n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$解答.
解答 解:同温同压下,同体积的H2和A气体,具有相同的分子数,依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$可知,分子数相同的气体,物质的量相同,气体的质量之比等于摩尔质量即相对分子质量之比,故H2和A气体的相对分子质量之比:$\frac{2}{M}$=$\frac{1.0}{16.0}$,则M=32,故A气体的相对分子质量为32.
故答案为:32.
点评 本题考查了物质的量的有关计算,明确阿伏伽德罗定律及以物质的量为核心的计算公式是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫元素的质量比为5:4 | B. | 分子数之比为1:1 | ||
| C. | 原子总数之比为2:3 | D. | 质量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 | pH | 现象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定生成有色产物能溶于浓硝酸 | |
| B. | 在KI淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应 | |
| C. | 在某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,说明含SO42- | |
| D. | 将铝片放入浓硫酸中,无明显实验现象,说明铝在冷的浓硫酸中不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 三处 | B. | 四处 | C. | 五处 | D. | 六处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度时,化学反应速率无论用A、B、C中任何物质表示,其数值都相同 | |
| B. | 其他条件不变时,降低温度,化学反应速率减小 | |
| C. | 其他条件不变时,增大压强,化学反应速率一定加快 | |
| D. | 若增大或减小A的物质的量,化学反应速率一定会发生明显的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
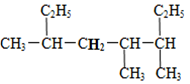
| A. | 4,5-二甲基-2-乙基庚烷 | B. | 3,4-二甲基-6-乙基庚烷 | ||
| C. | 4-甲基-2,5-二乙基己烷 | D. | 3,4,6-三甲基辛烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
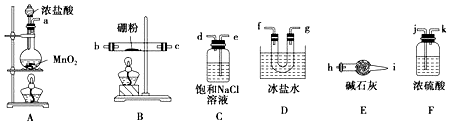
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
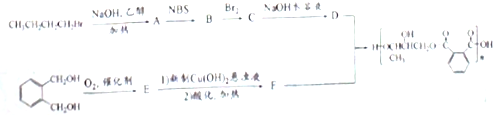

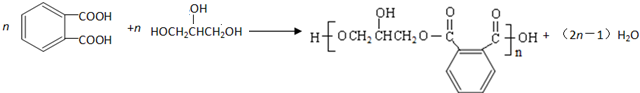
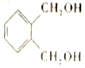 的符合下列条件的同分异构体有6 种(不考虑立体异构)
的符合下列条件的同分异构体有6 种(不考虑立体异构)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com