
| A、d=a+17b | ||
B、C1=
| ||
C、铝为
| ||
| D、与金属反应后剩余盐酸为(C1V1-b)mol |
| bg |
| 2g/mol |
| C2V2 |
| V1 |
|
|


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
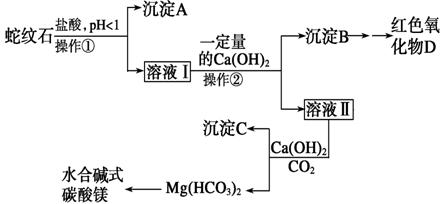
 蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(17分)蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成。实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
实验步骤如下:
请回答下列问题:
(1)实验室完成操作①所用到的玻璃仪器有________________ 。
(2)检验溶液Ⅱ中是否含有Fe3+的操作与结论是___________________________
_____________________________________________________________________。
(3)从沉淀混合物B中制取D,应加入一种试剂进行分离,其反应的离子方程式为________________________________________________________________________,
再进行__________、 、 (依次填写实验操作名称)。
(4)操作②中应控制溶液pH的合理范围是____(填序号)。
A.小于1.5 B.1.5~3.3
C.7~8 D.大于9.4
(5)为探究所得的水合碱式碳酸镁[xMgCO3·yMg(OH)2·zH2O]的组成,取样7.28 g于装置A的玻璃管中,请按由左―→右顺序将下列装置连接好(填序号,装置可重复使用):________________________________________________________________________,
装置C应盛的试剂是______________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省明光学校高三入学理科综合化学试卷 题型:实验题
(17分)蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成。实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
1.5 |
3.3 |
9.4 |
实验步骤如下:
请回答下列问题:
(1)实验室完成操作①所用到的玻璃仪器有________________ 。
(2)检验溶液Ⅱ中是否含有Fe3+的操作与结论是___________________________
_____________________________________________________________________。
(3)从沉淀混合物B中制取D,应加入一种试剂进行分离,其反应的离子方程式为________________________________________________________________________,
再进行__________、 、 (依次填写实验操作名称)。
(4)操作②中应控制溶液pH的合理范围是____(填序号)。
A.小于1.5 B.1.5~3.3
C.7~8 D.大于9.4
(5)为探究所得的水合碱式碳酸镁[xMgCO3·yMg(OH)2·zH2O]的组成,取样7.28 g于装置A的玻璃管中,请按由左―→右顺序将下列装置连接好(填序号,装置可重复使用):________________________________________________________________________,
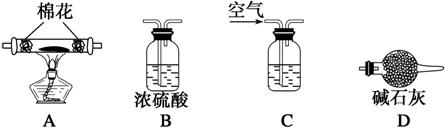
装置C应盛的试剂是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com