
(分)(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。
该反应中还原产物是______________________;若反应过程中转移了0.2![]() 电
电
子,则氧化产物的质量是________________________![]() 。
。
(2)将过量Cl2 通入 FeBr2溶液中,反应的离子方程式为:________________________;
(3)向NH4HCO3溶液中滴加少量的NaOH溶液,反应的离子方程式为______________;
(4)观察如下反应,总结规律,然后完成下列问题:
Al(OH)3 +H2O![]() Al(OH)4- + H+ NH3+H2O
Al(OH)4- + H+ NH3+H2O![]() NH4+ + OH-
NH4+ + OH-
①已知B(OH)3是一元弱酸,写出其电离方程式_____________________________
②N2H4是二元弱碱,写出其第二步电离方程式___________________ ____
科目:高中化学 来源:2013届山东临清三中高三半月考化学试卷(带解析) 题型:填空题
(8分)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2只发生如下过程:H2O2 → O2
(1)写出该反应的化学方程式,并标出电子转移的方向和数目。
(2)该反应中的氧化剂是 。
(3)若反应转移了0.3 mol电子,则产生的气体在标准状况下体积为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年重庆市高三9月月考理科综合试题(化学部分) 题型:填空题
(16分)(1)已知:还原性HSO3->I-,氧化性IO3->I2。在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应:NaIO3+NaHSO3→I2+Na2SO4+H2SO4+H2O
①配平上述反应的化学方程式(将化学计量数填在方框内);并写出其氧化产物____________。
②在NaIO3溶液中滴加过量NaHSO3溶液,反应完全后,推测反应后溶液中的还原产物为____________ (填化学式);
(2)向某密闭容器中加人0.15 mol/L A、0.05 mol/L C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示[t0时c(B)未画出,t1时增大到0.05 mol/L]。乙图为t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。

①若t4时改变的条件为减小压强,则B的起始物质的量浓度为________mol/L;
②若t1=15 s,则t0~t1阶段以C浓度变化表示的平均反应速率为v(C)=_______mol/(L·s)。
③t3时改变的某一反应条件可能是_______(选填序号)。
a使用催化剂 b增大压强 c增大反应物浓度
④有甲、乙两个容积均为2L的密闭容器,在控制两容器温度相同且恒定情况下,向甲中通入3mol A,达到平衡时,B的体积分数为20%,则向乙容器中充入1 mol C和0.5mol B,达到平衡时,C的浓度c(C)=________
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖南省高三上学期第二次月考化学试卷 题型:填空题
(4分)某一反应体系中有反应物和生成物共五种物质: 、
、 。已知该反应中
。已知该反应中 只发生如下过程:
只发生如下过程: 。
。
(1) 写出该反应的化学方程式,并标出电子转移的方向和数目。
_________________________________________________________________
(2) 如反应转移了0. 3 mol电子,则产生的气体在标况下体积为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
(每空2分)
计算:
(12分)(1)某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知:HCl是反应物之一。
①写出并配平该反应的化学方程式:
②在该反应中,得电子的物质是 ,被氧化的元素是 。
③在反应中,每转移1 mol电子,消耗HCl mol。
(2)将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
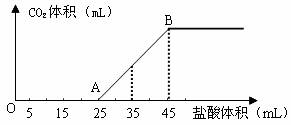
①写出OA段所发生反应的离子方程式______________________________________。
②当加入35mL盐酸时,产生CO2的体积为___________mL(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com