
下列说法不正确的是

A.用量筒量取一定量液体时,先从试剂瓶中直接倒入大部分试剂于量筒中,至接近刻度时改用上图所示操作,逐滴加入至刻度
B.金属镁因保存不当造成失火可用细沙盖灭,不能用泡沫灭火器
C.探究温度对化学反应速率影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热
D.可用热氢氧化钠溶液鉴别地沟油(餐饮废弃油)和矿物油(汽油、煤油等)
科目:高中化学 来源:2014-2015学年江苏省无锡市高三期末考试化学试卷(解析版) 题型:选择题
常温下,在指定的溶液中一定能大量共存的离子组是
A.使pH试纸变蓝的溶液:Al3+、Na+、SO42 -、Cl-
B.c(SO32-)=0.1 mol·L-1的溶液:K+、MnO4- 、SO42 -、H+
C.c(H+)/c(OH-)=1×10-12的溶液:K+、AlO2- 、CO32 -、Na+
D.加入苯酚显紫色的溶液:Na+、NH4+ 、Cl-、I-
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省张掖市高三第三次诊断考试理综化学试卷(解析版) 题型:选择题
NaOH标准溶液的配制和标定,需经过NaOH溶液配制、基准物质H2C2O42H2O的称量以及用NaOH溶液滴定等操作。下列有关说法正确的是

A.用图甲所示操作转移NaOH溶液到容量瓶中
B.用图乙所示装置准确称得0.1575gH2C2O42H2O固体
C.用图丙所示操作排除碱式滴定管中的气泡
D.用图丁所示装置以NaOH待测液滴定H2C2O4溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三十校联考理科综合化学试卷(解析版) 题型:选择题
废弃物资源化对于建设资源节约型社会具有重要的意义。铝灰是铝加工行业的废渣,其主要成分为Al、Al2O3,可能还含有KCl、FeO、Fe2O3、MgO、SiO2、MnO2中的若干种。为了确认其成分,某同学依次进行了以下实验:
①将过量的稀盐酸加入铝灰中,充分反应后过滤得到溶液甲和固体乙
②取少量溶液甲滴加AgNO3溶液,生成白色沉淀
③取少量溶液甲分成两等份,向其中一份滴加K3[Fe(CN)6]溶液,产生蓝色沉淀;向另一份滴加KSCN溶液,溶液变成血红色
④取少量溶液甲加入过量NaOH溶液,并置于空气中。充分反应后经过滤、洗涤、灼烧得到1.60g固体丙,将固体丙置于氢气流中加热充分反应后得到1.12g固体丁
根据以上实验现象或数据,该同学得出的结论正确的是:
A.根据①可推出铝灰中一定含有SiO2
B.根据②可推出铝灰中一定含有KCl
C.根据③可推出铝灰中一定含有FeO和Fe2O3
D.根据④可推出固体丙中一定不含MgO
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省协作体高三下学期联考理科综合化学试卷(解析版) 题型:实验题
(15分)氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g)  NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图装置制取氨气,你所选择的试剂是 。

(2)制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。

注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是: 、 。
液体石蜡鼓泡瓶的作用是: 。
②从反应后的混合物中分离出产品,为了得到干燥产品,应采取的方法是____ (填写选项序号)。
a.常压加热烘干
b.高压加热烘干
c.真空40 ℃以下烘干
③尾气处理装置如图所示。
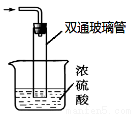
双通玻璃管的作用: ;浓硫酸的作用: 、 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品11.73 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为15.00 g。
则样品中氨基甲酸铵的物质的量分数为 _____ 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省协作体高三下学期联考理科综合化学试卷(解析版) 题型:选择题
某烷烃相对分子质量为86,如果分子中含有3个—CH3、2个—CH2—和1个 ,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构)
,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构)
A.9 B.6 B.5 D.4
查看答案和解析>>
科目:高中化学 来源:2014-2015山西省原平市高一上学期期末考试化学试卷(解析版) 题型:选择题
既能与盐酸反应,又能与NaOH溶液反应的是
①SiO2 ②Al(OH)3 ③NaHCO3 ④Al2O3 ⑤Na2CO3
A.全部 B.①②④ C.②④⑤ D.②③④
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省鸡西市龙东南四校高二上学期期末联考化学试卷(解析版) 题型:填空题
(12分) 已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/c2(CH3OH),该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44。请回答下列问题:
(1)写出上述反应的化学方程式: 。
(2)该反应的△H 0。
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
浓度/(molL-1) | 0.54 | 0.68 | 0.68 |
①此时温度400℃,则某时刻υ正 υ逆(填<、>或=,下同)。
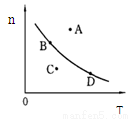
②若以温度为横坐标,以该温度下平衡态甲醇物质的量n为纵坐标,此时反应点在图象的位置是图中 点,比较图中B、D两点所对应的正反应速率υB υD,理由是 。
(4)一定条件下要提高反应物的转化率,可以采用的措施是 。
a.升高温度
b.加入催化剂
c.压缩容器的体积
d.增加水蒸气的浓度
e.及时分离出产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com