
| A、若V1>V2,c1=c2,则混合溶液的PH>7 |
| B、若混合溶液的PH=7,则c1V1<c2V2 |
| C、若c1=c2,混合溶液中c(NH4+)=c(Cl-),则V1>V2 |
| D、以上说法均不正确 |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
| 选项 | 实验目的 | 操作或现象 |
| A | 制备Fe(OH)3胶体 | 向25mL沸水中逐滴滴加饱和FeCl3溶液5~6滴,并加热至溶液呈红褐色时停止加热 |
| B | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入饱和硫酸钠溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| C | 测定氯水的pH | 用玻璃棒蘸 取氯水滴在pH试纸上,观察 |
| D | 证明溶液中存在平衡: Fe3++3SCN-?Fe(SCN)3 | 将1 mL KSCN溶液与1 mL 同浓度 FeCl3溶液充分混合;再滴加KSCN溶液,溶液颜色加深 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、m=2,R3+是还原产物 |
| B、m=6,R3+是氧化产物 |
| C、m=4,R3+是氧化产物 |
| D、m=8,R3+是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、烟花爆竹爆炸不易使用水来灭火,可用干沙 | ||||
| B、烟花爆竹的燃放产生大量污染气体,应加以限制 | ||||
| C、烟花爆竹燃放过程中硝酸钾做氧化剂 | ||||
D、爆竹爆炸过程中发生反应为2KNO3+3C+S
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在汽车排气管上加装“催化转化器”是为了减少有害气体的排放 |
| B、硬铝属于合金材料,瓷器属于硅酸盐制品 |
| C、食醋可去除水垢,NH4Cl溶液可去除铁锈 |
| D、煤经气化、液化和干馏三个物理变化过程,可变为清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原混合物中铜和铁各0.075 mol |
| B、稀硝酸的物质的量浓度为2.0 mol?L-1 |
| C、第一次剩余4.8 g 金属为铜和铁 |
| D、向反应后的溶液中再加入该稀硝酸100 mL,又得到NO在标准状况下体积小于1.12 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24L苯中含0.6NA个氢原子 |
| B、22.4LCl2通入水中充分反应,共转移NA个电子 |
| C、1L1mol?L-1氯化铜溶液中Cu2+的数目小于NA |
| D、0.1mol铁在0.1molCl2中充分燃烧,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
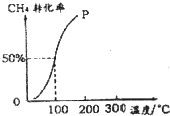 甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.
甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com