
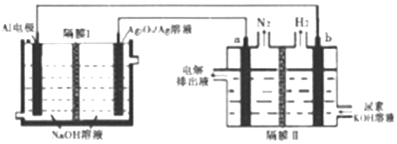
| A. | Ag电极是正极,反应后该电极区溶液pH减小 | |
| B. | 原电池的总反应为:2Al+3Ag2O2+2NaOH═2NaAlO2+3Ag2O+H2O | |
| C. | a电极上的电极反应为:CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O | |
| D. | 每消耗2.7g铝,理论上a、b两级共产生气体3.36L(标准状况) |
分析 A、a生成氮气,说明尿素被氧化,则Ag为正极,正极方程式为2H2O+2e-=H2↑+2OH-,反应后该电极区pH增大;
B、铝与电解质氢氧化钠溶液发生自发的氧化还原反应,所以原电池的总反应的方程为2Al+2H2O+2NaOH═2NaAlO2+3H2↑;
C、a电极上尿素[CO(NH2)2]发生氧化反应,电极反应式为:CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O;
D、2.7g的铝物质的量为:0.1mol,所以整个电路转移电子的物质的量为0.3mol,所以生成氮气的物质的量为0.05mol,氢气的物质的量为:0.15mol,所以上a、b两级共产生气体0.2mol,标况下体积为:4.48L.
解答 解:A、a生成氮气,说明尿素被氧化,则Ag为正极,正极方程式为2H2O+2e-=H2↑+2OH-,反应后该电极区pH增大,而不是减小,故A错误;
B、原电池的总反应的方程为2Al+2H2O+2NaOH═2NaAlO2+3H2↑,而不是2Al+3Ag2O2+2NaOH═2NaAlO2+3Ag2O+H2O,故B错误;
C、a电极上尿素[CO(NH2)2]发生氧化反应,生成氮气,和碳酸根离子,电极反应式为:CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O,故C正确;
D、2.7g的铝物质的量为:0.1mol,所以整个电路转移电子的物质的量为0.3mol,所以生成氮气的物质的量为0.05mol,氢气的物质的量为:0.15mol,所以上a、b两级共产生气体0.2mol,标况下体积为:4.48L,而不是3.36L,故D错误;
故选C.
点评 本题综合考查原电池以及电解原理,为高频考点,侧重于学生的分析能力的考查,明确元素化合价变化是解本题关键,根据元素化合价变化与阴阳极的关系来分析解答,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2O的质量为18 g•mol-1 | |
| B. | CH4的摩尔质量为16 g | |
| C. | 3.01×1023个SO2分子的质量为32 g | |
| D. | 1 mol NaCl溶于1 L水中,形成1 mol•L-1NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
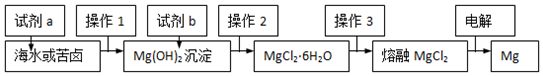
| A. | 流程中试剂a为NaOH溶液,试剂b为盐酸 | |
| B. | 操作2的具体方法是加热浓缩,冷却结晶 | |
| C. | 操作3是将晶体置于HCl气体氛围中脱水 | |
| D. | 电解MgCl2时,阳极生成Cl2,阴极生成Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色食品是不含任何化学物质的食品 | |
| B. | 灼烧某物质时,用肉眼直接观察到火焰呈黄色,则可判断该物质一定含钠元素 | |
| C. | 将镁条放在空气中充分燃烧,可以得到三种固体 | |
| D. | 称取等质量的两份铝粉,分别加入过量的稀HCl和过量的NaOH溶液,则放出氢气的体积相等(同温同压下) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O | |
| C. | 2,2-二甲基丙烷与Br2在光照下反应,其一溴取代物只有一种 | |
| D. | 含5个碳原子的有机物,每个分子中最多可形成4个C-C键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
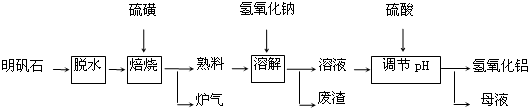
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6 | B. | 0.333 | C. | 0.4 | D. | 0.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取l.06g无水碳酸钠,在烧杯中加适量水溶解,待冷却到室温后,将溶液转移到容量瓶中 | |
| B. | 定容时,若仰视,则所配溶液的浓度将偏高 | |
| C. | 定容时,若加水超过刻度线,可用胶头滴管小心吸出多余部分 | |
| D. | 在使用容避瓶前必须检查容量瓶是否完好以及瓶塞处是否漏水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com