
| A. | 加入碳酸锰的目的是除去Fe3+ | |
| B. | 常温下pH=4时,Fe3+已除尽 | |
| C. | Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq)的K=2.73×10-23 | |
| D. | Mn2(OH)2CO3、Mn(OH)2都可以替代MnCO3 |
分析 由各物质的Ksp大小可知,调节溶液的pH,可生成Fe(OH)3沉淀,由于Ksp(CuS<Ksp(MnS),可使MnS转化成CuS,则除去硫酸锰溶液中含有CuSO4、Fe2(SO4)3杂质,向溶液中加入MnCO3,也可加入Mn2(OH)2CO3、Mn(OH)2,调节溶液pH,生成Fe(OH)3沉淀,充分反应过滤,再加入MnS,可生成CuS,以此解答该题.
解答 解:A.由Ksp[Fe(OH)3]=4.0×10-38,可知Fe(OH)3易生成沉淀,可加入MnCO3,起到调节溶液pH的作用,可除去Fe3+,故A正确;
B.Ksp[Fe(OH)3]=4.0×10-38,当Fe3+已除尽时,c(OH-)=$\root{3}{\frac{4.0×1{0}^{-38}}{1×1{0}^{-5}}}$mol/L=1.58×10-11mol/L,pH≈3.7,故B正确;
C.反应Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq)的K=$\frac{c(M{n}^{2+})}{c(C{u}^{2+})}$=$\frac{Ksp(MnS)}{Ksp(CuS)}$=$\frac{4.65×1{0}^{-14}}{1.27×1{0}^{-36}}$=3.66×1022,故C错误;
D.Mn2(OH)2CO3、Mn(OH)2与MnCO3性质相似,都可与氢离子反应生成二氧化碳和水,不引入新杂质,可代替,故D正确.
故选C.
点评 本题考查难溶电解质的溶解平衡,侧重于学生的分析能力和计算能力的考查,注意把握溶度积的意义及应用,把握相关计算方法,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
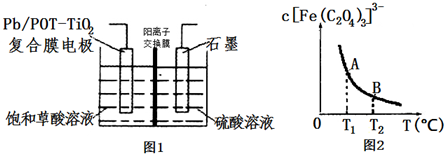
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | C-C | C-H | H-H | C-O | C≡0 | H-O |
| 键能(kJ•mol-1) | 348.0 | 413.0 | 436.0 | 358.0 | 1072.0 | 463.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
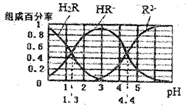
| A. | 在pH=4.4的溶液中:3c(HR-)=c(Na+)+c(H+)-c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2R溶液混合后,溶液中水的电离程度比纯水小 | |
| C. | 在pH=3的溶液中存在 $\frac{c({R}^{2-})×c({H}_{2}R)}{c(H{R}^{-})^{2}}$=10-3.1 | |
| D. | 向Na2CO3溶液中加入少量H2R溶液,发生反应:CO32-+H2R=HCO3-+HR- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

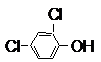 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
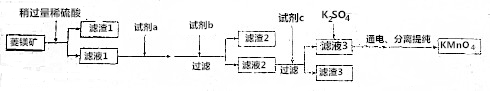
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉定时 | 8.3 | 7.6 | 2.7 | 6.7 |
| 完全沉淀时 | 9.8 | 9.6 | 3.7 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
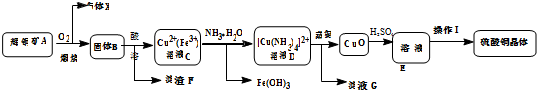

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 | |
| B. | H2O2、Na202、SO2都具有漂白性且漂白原理相同 | |
| C. | 饱和Na2C03溶液中通入CO2溶液会变浑浊 | |
| D. | 可用石灰水吸收尾气中的S02气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com