
分析 (1)钠的焰色反应为黄色,金属钠性质活泼,在氧气中燃烧生成Na2O2,反应的化学方程式为2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,过氧化钠是淡黄色,钠为+1价,氧是-1价,由此解答;
(2)根据碳酸氢钠的俗称、碳酸钠是强碱弱酸盐要水解知识来回答.
解答 解:(1)钠的焰色反应为黄色,金属钠性质活泼,在氧气中燃烧生成Na2O2,反应的化学方程式为2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,过氧化钠是淡黄色,钠为+1价,氧是-1价,故答案为:黄;2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2;淡黄色;过氧化钠;+1;-1;
(2)碳酸氢钠俗称小苏打、碳酸氢钠是强碱弱酸盐,碳酸氢根离子要水解,水解显示碱性,故答案为:小苏打;碱.
点评 本题考查钠的单质及化合物的性质,题目难度不大,注意碳酸氢钠的俗称,水解呈碱性,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 元素原子最外层电子数越多,元素金属性越强 | |
| B. | 非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强 | |
| C. | Si、P、S、Cl元素的单质与氢气化合越来越容易 | |
| D. | F-、O2-、Mg2+、Na+离子半径逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑧ | D. | ①⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| C. | 醋酸跟氢氧化钾溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| D. | 碳酸镁跟硫酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是沙子的主要成分,纯净的SiO2是光纤制品的基本原料 | |
| B. | 水晶的基本结构单元是[SiO4]四面体结构 | |
| C. | 将游离态的氮转变为氮的化合物就是氮的固定,合成氨是一种人工固氮方法 | |
| D. | 将等物质的量的氯气和二氧化硫同时通入品红溶液中,褪色比二氧化硫通入品红溶液快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中的还原剂是C、氧化剂是S和KNO3 | |
| B. | 能做炸药的原因之一是固体物质反应生成了大量的气体 | |
| C. | 由此反应可推出S的氧化性强于N2 | |
| D. | 当生成标准状况下4.48L气体时,共转移电子0.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
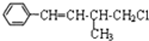
| A. | 1mol该有机物在加热和催化剂作用下,最多能和4molH2反应 | |
| B. | 该有机物分子式为C11H13Cl | |
| C. | 该有机物遇硝酸银溶液产生白色沉淀 | |
| D. | 该有机物在一定条件下,能发生消去反应或取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
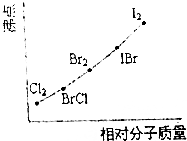 (1)在已知存在H2、Cl2、I2、HCl和Hl的时代,根据原子通过共价键形成分子的基本特点(如下图),推测还可能存在的一种化合物(A),其化学式为ICl.
(1)在已知存在H2、Cl2、I2、HCl和Hl的时代,根据原子通过共价键形成分子的基本特点(如下图),推测还可能存在的一种化合物(A),其化学式为ICl. | H- | Cl- | I- | |
| -H | H-H | H-Cl | H-I |
| -Cl | H-Cl | Cl-Cl | |
| -I | H-I | I-I |
| 反应物 | 化合物(A) | Br2 |
| Na | 2Na+Br2=2NaBr | |
| H2 | H2+Br2=2HBr | |
| H2O | H2O+Br2?HBr+HBrO | |
| Kl | 2Kl+Br2=I2+2KBr |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com