
| A. | 丙烯(CH2=CH-CH3)聚合后的结构简式: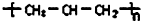 | |
| B. | 乙醇的结构式:CH3CH2OH | |
| C. | 四氯化碳分子的电子式为: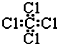 | |
| D. | 丙烷分子的球棍模型为: |
分析 A.聚丙烯是加成聚合产物,链节上是断裂碳碳双键相互连接形成高聚物;
B.结构式需要把形成的化学键全部用“-”表示出来;
C.氯原子未成键的孤对电子对未标出;
D.球棍模型突出的是原子之间的成键的情况及空间结构,丙烷是饱和烷烃,碳原子形成化学键都是四面体结构.
解答 解:A.聚丙烯是加成聚合产物结构简式为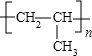 ,故A错误;
,故A错误;
B.乙醇中含有CH3CH2-和-OH,结构式为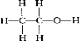 ,故B错误;
,故B错误;
C.氯原子未成键的孤对电子对未标出,四氯化碳电子式为 ,故C错误;
,故C错误;
D. 原子之间为单键,主链有3个碳原子,氢原子数为8个,符合丙烷的结构,故D正确;
原子之间为单键,主链有3个碳原子,氢原子数为8个,符合丙烷的结构,故D正确;
故选D.
点评 本题考查化学用语的使用,化学用语是高考的热点,要熟练掌握常用的化学用语,注意不同化学用语的书写要求,特别注意电子式书写不能忽略未成键电子的标注,题目难度不大.


科目:高中化学 来源: 题型:实验题


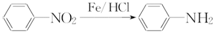 (苯胺,易被氧化)
(苯胺,易被氧化)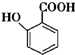 不可选用的试剂有c(填标号).
不可选用的试剂有c(填标号).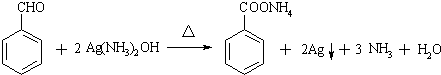 ;若F为高分子化合物,则反应⑦的化学方程式为n
;若F为高分子化合物,则反应⑦的化学方程式为n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$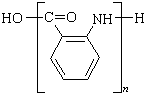 +(n-1)H2O.
+(n-1)H2O.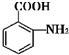 的合成路线流程图(无机试剂任用).合成路线流程图示例如下(已知
的合成路线流程图(无机试剂任用).合成路线流程图示例如下(已知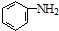 容易被氧化剂氧化):
容易被氧化剂氧化):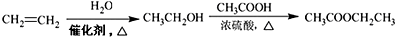 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
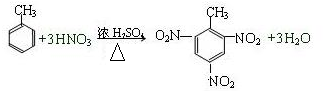
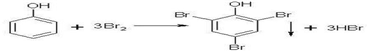 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2+2Y2?2XY2 | B. | 3X2+Y2?2X3Y | C. | X2+3Y2?2XY3 | D. | 2X2+2Y2?2X2Y |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
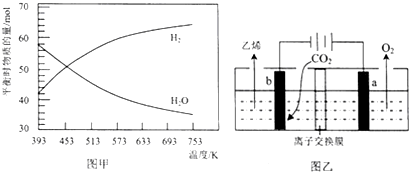
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解时在阳极得到金属钠 | |
| B. | 在阴极附近的溶液中滴入酚酞溶液,溶液呈红色 | |
| C. | 在阴极附近有黄绿色的气体产生,并能使湿润淀粉碘化钾试纸变蓝 | |
| D. | 电解一段时间后,将电解液全部转移到烧杯中,充分搅拌后溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是一种国际基本物理量 | |
| B. | 标准状况下气体摩尔体积约为22.4 L | |
| C. | 氢的摩尔质量是2 g/mol | |
| D. | 在同温同压下,相同体积的任何气体单质所含分子数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com