
【题目】某课外小组研究铝土矿中Al2O3的含量。已知铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
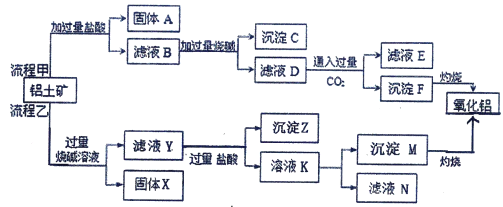
(1)流程甲中加入盐酸后生成Fe3+的离子方程式为________________;固体A是___________(填化学式),写出沉淀F转化为氧化铝的化学方程式是___________________________。
(2)流程乙中,向铝土矿中加入过量烧碱溶液后,发生反应的离子方程式是__________;固体X的主要用途有(写出1条即可) _____。沉淀Z为_______(填化学式)。由溶液K生成沉淀M的离子方程式是_________________________。
(3)流程乙中,将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________(保留一位小数)
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是__________________。
【答案】 Fe2O3+6H+=2Fe3++3H2O SiO2 2Al(OH)3![]() Al2O3+3H2O Al2O3+20H-+3H2O=2[Al(OH)4]-;SiO2+2OH-=SiO32-+H2O 炼铁原料或用作涂料、油漆等 H2SiO3 Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 65.4% Al2O3+3Cl2+3C
Al2O3+3H2O Al2O3+20H-+3H2O=2[Al(OH)4]-;SiO2+2OH-=SiO32-+H2O 炼铁原料或用作涂料、油漆等 H2SiO3 Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 65.4% Al2O3+3Cl2+3C![]() 2AlCl3+3CO
2AlCl3+3CO
【解析】考查化学工艺流程,(1)铝土矿中含有Fe2O3,属于碱性氧化物,与盐酸反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O;氧化铝为两性氧化物,与盐酸反应生成AlCl3,SiO2属于酸性氧化物,不与盐酸反应,即固体A为SiO2;流程甲中加入过量NaOH,发生Fe3++3OH-=Fe(OH)3↓、H++OH-=H2O、Al3++4OH-=AlO2-+2H2O,通入过量的CO2,发生CO2+OH-=HCO3-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,沉淀F为Al(OH)3,灼烧氢氧化铝,发生:2Al(OH)3![]() Al2O3+3H2O;(2)氧化铝为两性氧化物,能与氢氧化钠反应,SiO2属于酸性氧化物,能与氢氧化钠反应,离子方程式为:Al2O3+2OH-=2AlO2-+H2O或Al2O3+2OH-+3H2O=2[Al(OH)4]-、SiO2+2OH-=SiO32-+H2O;固体X为Fe2O3,用途可以作炼铁的原料、涂料、油漆等;滤液Y中加入过量盐酸,发生:H++OH-=H2O、AlO2-+4H+=Al3++2H2O、SiO32-+2H+=H2SiO3↓,沉淀Z为H2SiO3,溶液K生成沉淀M的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+;(3)令氢氧化铝的质量为xg,根据信息,铝土矿质量为xg,根据元素守恒,氧化铝的质量为102x/(2×78)g,则铝土矿中氧化铝的质量分数为102x/(2×78×x)×100%=95.4%;(4)Al、O两种元素的化合价不变,根据制备的物质,以及氯气表现氧化性,Cl2中Cl的化合价降低,C的化合价应升高,0.5molC被消耗,转移电子物质的量1mol,即C的化合价的变化2价,C被氧化成CO,因此反应方程式为:Al2O3+3Cl2+3C
Al2O3+3H2O;(2)氧化铝为两性氧化物,能与氢氧化钠反应,SiO2属于酸性氧化物,能与氢氧化钠反应,离子方程式为:Al2O3+2OH-=2AlO2-+H2O或Al2O3+2OH-+3H2O=2[Al(OH)4]-、SiO2+2OH-=SiO32-+H2O;固体X为Fe2O3,用途可以作炼铁的原料、涂料、油漆等;滤液Y中加入过量盐酸,发生:H++OH-=H2O、AlO2-+4H+=Al3++2H2O、SiO32-+2H+=H2SiO3↓,沉淀Z为H2SiO3,溶液K生成沉淀M的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+;(3)令氢氧化铝的质量为xg,根据信息,铝土矿质量为xg,根据元素守恒,氧化铝的质量为102x/(2×78)g,则铝土矿中氧化铝的质量分数为102x/(2×78×x)×100%=95.4%;(4)Al、O两种元素的化合价不变,根据制备的物质,以及氯气表现氧化性,Cl2中Cl的化合价降低,C的化合价应升高,0.5molC被消耗,转移电子物质的量1mol,即C的化合价的变化2价,C被氧化成CO,因此反应方程式为:Al2O3+3Cl2+3C![]() 2AlCl3+3CO。
2AlCl3+3CO。


科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
SiO2(s)+ C(s)+ N2(g)![]() Si3N4(s)+ CO(g)
Si3N4(s)+ CO(g)
(1)配平反应中各物质的化学计量数______,已知生成1 mol氮化硅(Si3N4)放出1 591.2 kJ的热量,该反应每转移1 mol e-,放出______kJ的热量。
(2)该反应的平衡常数表达式为K=____。升高温度,其平衡常数______(选填“增大”“减小”或“不变”)。
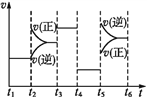
(3)该化学反应速率与反应时间的关系如上图所示,t2时引起v(正)突变、v(逆)渐变的原因是_________,t3引起变化的因素为_________,t5时引起v(逆)大变化、v(正)小变化的原因是_________。
(4)利用右图装置,可以模拟铁的电化学防护。
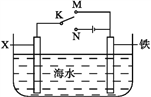
若X为碳棒,为减缓铁的腐蚀,开关K应置于___处。若X为锌,开关K置于M处,该电化学防护法称为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某微粒用 AZQn+表示,下列关于该微粒的叙述正确的是( )
A.所含质子数=A-nB.所含中子数=A-Z
C.所含电子数=Z+nD.质量数=Z+A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解Na2PbCl4溶液,生成Pb,装置如下图,下列说法不正确的是
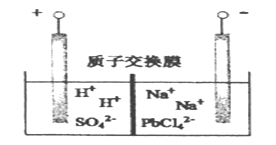
A. 阴极的电极反应式为 PbCl42- +2e- =Pb + 4Cl-
B. 电解一段时间后,Na2PbCl4浓度极大下降,可加入PbO恢复其浓度
C. 电解过程中阳极溶液的pH减小,阴极的pH保持不变
D. 电路中通过0.2mol,则阴极的质量增加20.7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有6.02×1024个CO2,这些分子的物质的量是________mol,这些分子的质量是_______g,这些分子在标准状况下的体积是____________升,其中氧原子的个数是_____________个(NA可取6.02×1023mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱水环化是合成生物碱类天然产物的重要步骤,某生物碱V合成路线如下:
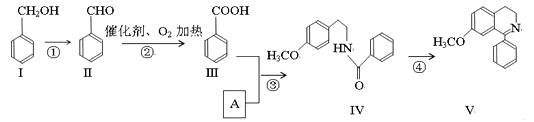
(1)写出Ⅳ中含氧官能团的名称_____________________。
(2)写出Ⅳ物质的分子式_____________。
(3)写出下列反应的类型②___________,③________________。
(4)反应②的化学方程式___________________________________。
(5)Ⅰ和Ⅲ在浓硫酸催化加热时反应的化学方程式__________________________。
(6)A的结构简式_______________________。
(7)Ⅵ与Ⅰ互为同分异构体,Ⅵ遇FeCl3发生显色反应,其苯环上的一氯代物只有2种。写出满足上述条件的Ⅵ的结构简式________________________。
(8)一定条件下,化合物Ⅶ(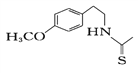 )也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式__________________________________。
)也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X的最低负价与Y的最高正价代数和为零,下列说法正确的是
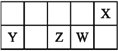
A. 原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X)
B. Z的最高价氧化物对应水化物的酸性比W的强
C. X的简单气态氢化物的稳定性比W的弱
D. X分别与Y、Z形成的化合物中化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( ) 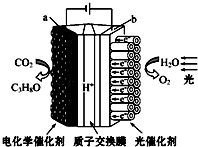
A.该装置将化学能转化为光能和电能
B.a电极的反应为:3CO2+18H+﹣18e﹣═C3H8O+5H2O
C.每生成1 mol O2 , 有44 g CO2被还原
D.该装置工作时H+从b极区向a极区迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
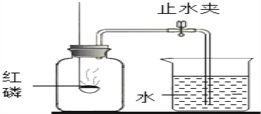
【题目】“空气中氧气体积分数的测定”有多种方法,请按要求回答下列问题:在燃烧匙内盛过量红磷,红磷必须过量的原因是______,点燃红磷后立即插入集气瓶内,塞紧橡皮塞红磷燃烧的现象是____________,其反应的化学方程式为____________________。待红磷火焰熄灭,集气瓶冷却至室温,打开止水夹,观察到的现象是______,该实验除了得出氧气在空气中的体积分数之外,还能得出氮气具有的性质是______(任写一点);若测得空气中氧气的体积分数约为1/7,则可能的原因是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com