
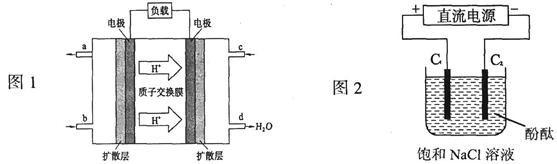
 =10-9mol/L,所以pH=5。
=10-9mol/L,所以pH=5。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.AgCl不溶于水,不能转化为AgI |
| B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质 |
| C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于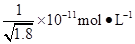 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.AgCl不溶于水,不能转化为AgI |
| B.两种不溶物的KSP相差越大,不溶物就越容易转化为更难溶的不溶物 |
| C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI |
D.常温下,AgCl若要在Nal溶液中开始转化为AgI,则NaI的浓度必须不低于 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.25℃时,Fe(OH)3的溶解度大于Al(OH)3的溶解度 |
| B.25℃时,Fe(OH)3的溶度积大于Al(OH)3的溶度积 |
| C.当生成的Al(OH)3恰好完全溶解时,溶液中的溶质只有NaAlO2 |
| D.图中2a=b=6(c-b) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
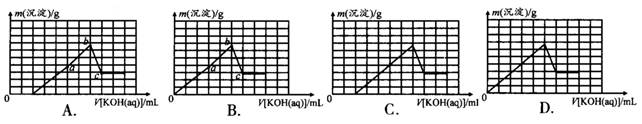
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 M2+(aq)+2OH-(aq) Ksp=a,c(M2+)="b" mol·L-1时,溶液的pH等于( )
M2+(aq)+2OH-(aq) Ksp=a,c(M2+)="b" mol·L-1时,溶液的pH等于( )A.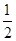 lg( lg(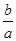 ) ) | B.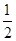 lg( lg(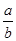 ) ) |
C.14+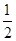 lg( lg(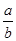 ) ) | D.14+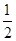 lg( lg(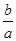 ) ) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com