
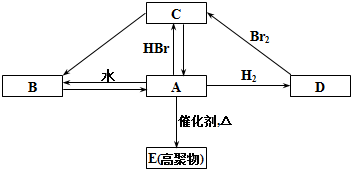
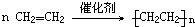
分析 A分子中所有原子共平面,A能使高锰酸钾溶液褪色,少量的A物质存在于植物体内,是植物的一种代谢产物,能使植物生长减慢,促进叶落和果实成熟,故A为CH2=CH2,根据题中各物质转化关系,A与水加成得B为CH3CH2OH,A与溴化氢加成得C为CH3CH2Br,C发生消去反应得A,A与氢气加成得D为CH3CH3,A发生加聚反应得E为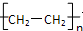 ,据此答题.
,据此答题.
解答 解:A分子中所有原子共平面,A能使高锰酸钾溶液褪色,少量的A物质存在于植物体内,是植物的一种代谢产物,能使植物生长减慢,促进叶落和果实成熟,故A为CH2=CH2,根据题中各物质转化关系,A与水加成得B为CH3CH2OH,A与溴化氢加成得C为CH3CH2Br,C发生消去反应得A,A与氢气加成得D为CH3CH3,A发生加聚反应得E为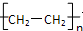 ,
,
(1)根据上面的分析可知,反应A→B为加成反应,反应C→A为消去反应,故答案为:加成反应;消去反应;
(2)C→B的化学方程式为CH3CH2Br+NaOH$→_{△}^{水}$CH3CH2OH+NaBr,
B→A 的化学方程式为CH3CH2OH $→_{△}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,
A→E 的化学方程式为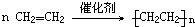 ,
,
故答案为:CH3CH2Br+NaOH$→_{△}^{水}$CH3CH2OH+NaBr;CH3CH2OH $→_{△}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O;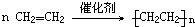 ;
;
(3)在A、B、C、D分子中,乙醇与二甲醚互为同分异构体,故选B,CH3CH2Br中核磁共振氢谱中只出现两组峰,故选C,
故答案为:B;C.
点评 本题考查有机推断,涉及烯烃、醇、卤代烃等物质的性质以及学生推理能力等,是对有机化合物知识的综合考查,能较好的考查考生的思维能力,难度中等,是高考热点题型.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,Y、Z为同周期金属元素,Y、Z的最高价氧化物对应水化物可以反应生成盐和水.回答下列问题:
,Y、Z为同周期金属元素,Y、Z的最高价氧化物对应水化物可以反应生成盐和水.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.20mol | B. | 0.21mol | C. | 0.22mol | D. | 0.23mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | baXn-中含有的中子数为a+b | B. | baXn-中含有的电子数为a-n | ||
| C. | X原子的质量约为(b/NA)g | D. | 此元素的相对原子质量为b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | R:0.08mol•L-1 | B. | Q:0.05mol•L-1 | C. | X:0.12mol•L-1 | D. | Y:0.06mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com