
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
| n(OH-)-n(H+) |
| V酸+V碱 |
| n(OH-)-n(H+) |
| V酸+V碱 |
| 0.005×2×x-0.00125×y |
| x+y |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:向盛有固体K2Cr2O7的A、B两试管中分别加入一定量的稀硫酸 | |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| OH- |
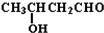
| -H2O |
| △ |
 +CO
+CO| AlCl3,HCl |
| △ |
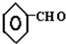
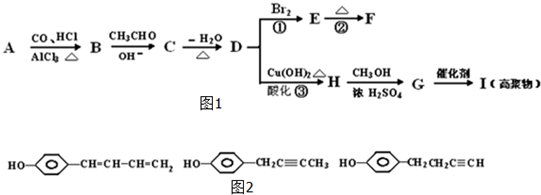
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用物质B表示反应的平均速率为0.3 mol?L-1?s-1 |
| B、2 s时气体密度与起始时气体密度之比为3:2 |
| C、2 s时物质A的转化率为70% |
| D、2 s时物质B的浓度为0.7 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
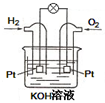 (1)已知:
(1)已知:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、易溶于水 |
| B、与澄清石灰水反应产生白色沉淀 |
| C、与足量盐酸反应放出气体 |
| D、属于碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com