
| A. | 苯乙烯(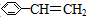 ) ) | B. | 苯甲酸(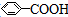 ) ) | C. | 苯甲醛(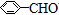 ) ) | D. | 苯乙酮(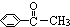 ) ) |
分析 在常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行判断,注意结合信息中甲醛的平面结构.
解答 解:A、苯为平面结构,乙烯为平面结构,通过旋转乙烯基连接苯环的单键,可以使两个平面共面,故苯乙烯中所有的原子可能处于同一平面,故A不符合;
B、旋转羧基中的C-O单键,可以使羧基中的所有原子处于同一平面,通过旋转羧基连接苯环的单键,可以使两个平面共面,故苯甲酸中所有的原子可能处于同一平面,故B不符合;
C、苯环为平面结构,醛基为平面结构,通过旋转醛基连接苯环的单键,可以使两个平面共面,故苯甲醛中所有的原子可能处于同一平面,故C不符合;
D、分子中存在甲基,具有甲烷的四面体结构,所有原子不可能处于同一平面,故D符合.
故选D.
点评 本题主要考查有机化合物的结构特点,做题时注意从甲烷、乙烯、苯和乙炔的结构特点判断有机分子的空间结构,其中单键可以旋转.


科目:高中化学 来源: 题型:解答题
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.117 | 0.074 | 0.110 | 0.071 | 0.075 | 0.077 | 0.099 |
| 最高化合价 | +6 | +4 | +5 | +5 | +4 | +7 | ||
| 最低化合价 | -2 | -4 | -2 | -3 | -1 | -3 | -4 | -1 |
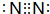 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
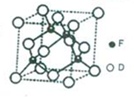 A、B、D、E、F是原子序数依次增大的五种前四周期元素,相关信息如下:
A、B、D、E、F是原子序数依次增大的五种前四周期元素,相关信息如下:| A | 原子半径最小的元素 |
| B | 原子核外电子有6种不同的运动状态 |
| E | 原子L电子层上有两个未成对电子 |
| F | 原子最外层有2个电子,次外层电子数为D原子最外层电子数的2倍 |
 ,能量最高的电子占据的能级符号为3d,该能级所在能层具有的原子轨道数为9.
,能量最高的电子占据的能级符号为3d,该能级所在能层具有的原子轨道数为9.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑥ | B. | ②③⑤ | C. | ①②④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
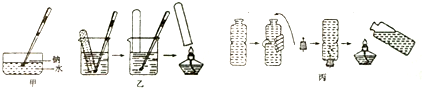
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其分子中的原子都在一条直线上 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 能发生加成反应 | D. | 可由乙炔和含氮化合物加聚制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 名称或俗名 | 主要用途 |
| K2FeO4 | 高铁酸钾 | 高能材料、水处理剂和氧化剂 |
| H2C2O4 | 草酸 | 重要还原剂、菠菜成分之一 |
| KAl(SO4)2•12H2O | 明矾 | 净水剂、用于制油条和糕点 |
| Cu2O | 氧化亚铜 | 用于制红色涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鉴别葡萄糖溶液和淀粉溶液:加入新制的Cu(OH)2悬浊液加热或加碘水 | |
| B. | 鉴别织物成分是真丝还是人造丝:用灼烧的方法 | |
| C. | 鉴别淀粉溶液和蛋白质溶液:加入稀KI溶液 | |
| D. | 鉴别乙烷和乙烯:分别将气体通入溴水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 3.8 | - |
| Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
| Fe(OH)2 | 8.0×10-16 | 6.95 | 9.95 |
| Ni(OH)2 | 6.5×10-18 | 5.9 | 8.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com