
(8��)ijѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯������100 mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼����(�ۼ�ֵ�����������Ϊ������)��
| ʱ��(min) | 1 | 2 | 3 | 4 | 5 |
| �������(mL) | 50 | 120 | 232 | 290 | 310 |
��2-3min ��Ӧ���ȣ��¶����ߣ���Ӧ���ʼӿ�
��0.1mol/(L��min) ��AB
���������������1����0��1��1��2��2��3��3��4��4��5minʱ����У��������������ֱ��ǣ�50 mL�� 70mL ��112mL��68mL��20 mL���ɴ�֪��Ӧ��������ʱ���Ϊ2-3min����Ӧ���ʸտ�ʼ�����������С�뷴Ӧ���Ũ���أ�ֻ�����뷴Ӧ����ЧӦ�йء�
��2����2��3����ʱ����ڣ�n(H2)= 0.112L/22.4L/moL=0.005mol����������������ʵ���=2n(H2)����ԣ�HCl��=0.1mol/(L��min)��
��3��A����������ˮ��H+Ũ�ȼ�С����Ӧ���ʼ�С��������������������ȷ��B������NaCl��Һ��H+Ũ�ȼ�С����Ӧ���ʼ�С��������������������ȷ��C������NaNO3��Һ������NO���壬Ӱ��������������������D������CuSO4��Һ��Zn�û���Cu�γ�ԭ��أ�ʹ��Ӧ��������Ӱ��������������������E������Na2CO3��Һ������H+��ʹH+Ũ�ȼ�С��Ӱ��������������������
���㣺��ѧ��Ӧ���ʵļ��㣬Ӱ�컯ѧ��Ӧ���ʵ����ء�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
100mL 6 mol / L H2SO4������п�۷�Ӧ����һ���¶��£�Ϊ�˼�����Ӧ���е����ʣ����ֲ�Ӱ����������������������Ӧ���м���������
| A���������Һ | B������ | C���Ȼ��ƣ����壩 | D������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��������ЧӦ����Դ��ȱ�����⣬��ν��ʹ����е�CO2���������Կ������ã������˸������ձ����ӡ�Ŀǰ��ҵ����һ�ַ�������CO2����ȼ�ϼ״�, һ�������·������·�Ӧ��
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
��1��д���÷�Ӧ��ƽ�ⳣ������ʽ��K�� ����֪��K(300��)��K(350��)����÷�Ӧ��_______��Ӧ��������ȡ����ȡ���
��2�������������˵���÷�Ӧһ���ﵽƽ�����
A��������ƽ��ƽ����Է����������� B��������ѹǿ����
C��λʱ��������3mol H��H����ͬʱ����2 mol C=O��
D����������� c (H2) : c (CH3OH) = 3:1
��3��Ϊ̽����Ӧԭ�����ֽ�������ʵ�飺�����Ϊ1L�ĺ����ܱ������У�����1molCO2��3molH2�����CO2��CH3OH(g)��Ũ����ʱ��仯����ͼ��ʾ���ӷ�Ӧ��ʼ��ƽ�⣬��H2Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(H2)Ϊ mol��L��1��min��1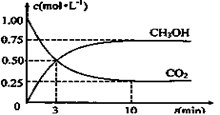
��4�����д�ʩ����ʹ��3������n(CH3OH)/n(CO2)������� ��(����ĸ)
A�����¶� B������� C��H2O(g)����ϵ�з���
D����He(g)��ʹ��ϵ��ѹǿ���� E���ٳ���1molCO2��3molH2
��5��������һ���ܱ������г���1 mol CO2��3 mol H2������ѹǿ����,��ʹ��ʼ����루3���������������ȣ�������ͬ���¶��½��з�Ӧ���ﵽƽ��ʱ�������е�CO2������ٷ��� ________��3�����е�CO2������ٷ�����(�>����<����=��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��14�֣���̼����(��Ҫָ����CO2)�ڽ������������ŷ��о�����Ҫ�����á�ĿǰNH3��(NH4)2CO3�Ѿ���������ҵ��̼����������CO2�ɷ������¿��淴Ӧ��
��Ӧ��2NH3(l)��H2O(l)��CO2(g)  (NH4)2CO3(aq) ��H1
(NH4)2CO3(aq) ��H1
��Ӧ��NH3(l)��H2O(l)��CO2(g)  NH4HCO3(aq) ��H2
NH4HCO3(aq) ��H2
��Ӧ��(NH4)2CO3(aq)��H2O(l)��CO2(g)  2NH4HCO3(aq) ��H3
2NH4HCO3(aq) ��H3
��ش��������⣺
(1)��H3�릤H1����H2֮��Ĺ�ϵ�ǣ���H3�� ��
(2) ��Ӧ��Ļ�ѧƽ�ⳣ������ʽΪ ��
(3)Ϊ�о��¶ȶ�(NH4)2CO3����CO2Ч�ʵ�Ӱ�죬��ij�¶�T1�£���һ������(NH4)2CO3��Һ�����ܱ������У�������һ������CO2����(�õ�����Ϊϡ�ͼ�)����tʱ�̣����������CO2�����Ũ�ȡ�Ȼ��ֱ����¶�ΪT2��T3��T4��T5�£�����������ʼʵ���������䣬�ظ�����ʵ�飬������ͬʱ����CO2����Ũ�ȣ��õ�����ͼ(��ͼ1)����
�٦�H3 0(�����������������)��
����T1��T2��T4��T5�����¶����䣬������CO2����Ũ�ȳ�����ͼ1��ʾ�ı仯���ƣ���ԭ����
��
�۷�Ӧ�����¶�ΪT1ʱ����ҺpH��ʱ��仯������������ͼ2��ʾ����ʱ�䵽��t1ʱ�����÷�Ӧ��ϵ�¶�Ѹ��������T2����ά�ָ��¶ȡ����ڸ�ͼ�л���t1ʱ�̺���Һ��pH�仯���������ߡ�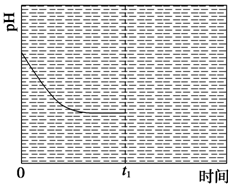
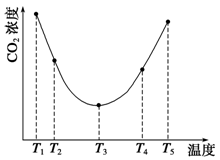
ͼ1 ͼ2
(4)���÷�Ӧ��CO2����(NH4)2CO3��ʼŨ�Ⱥ����ȷ��������£����CO2�������Ĵ�ʩ��
��
(5)����������Ҳ������ΪCO2��������� ��
| A��NH4Cl | B��Na2CO3 | C��HOCH2CH2OH | D��HOCH2CH2NH2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��14�֣��״��������ѵȱ���Ϊ��ɫ��Դ����ҵ��������Ȼ��Ϊ��Ҫԭ���������̼��ˮ������һ���������Ʊ��ϳ�����CO��H2�������Ƴɼ״��������ѣ�CH3OCH3����
��1����֪1g������������ȫȼ�������ȶ���������ų�������Ϊ32kJ����д��������ȼ���ȵ��Ȼ�ѧ����ʽ____________________________________________________________________��
��2��д�������Ѽ���ȼ�ϵ�صĸ����缫��Ӧʽ __________________________________��
��3���úϳ����Ʊ������ѵķ�Ӧԭ��Ϊ��2CO(g) + 4H2(g) CH3OCH3(g) + H2O(g)����֪һ�������£��÷�Ӧ��CO��ƽ��ת�������¶ȡ�Ͷ�ϱ�[n(H2) / n(CO)]�ı仯����������ͼ��
CH3OCH3(g) + H2O(g)����֪һ�������£��÷�Ӧ��CO��ƽ��ת�������¶ȡ�Ͷ�ϱ�[n(H2) / n(CO)]�ı仯����������ͼ��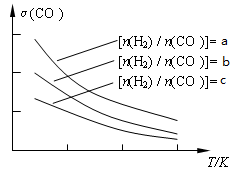
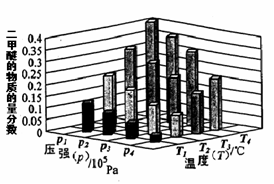
��a��b��c���Ӵ�С��˳������Ϊ_________________���÷�Ӧ�ġ�H_______0�������������������
��ij�¶��£���2.0molCO(g)��4.0molH2(g)�����ݻ�Ϊ2L���ܱ������У���Ӧ����ƽ��ʱ���ı�ѹǿ���¶ȣ�ƽ����ϵ��CH3OCH3(g)�����ʵ��������仯�������ͼ��ʾ�������¶Ⱥ�ѹǿ�Ĺ�ϵ�ж���ȷ���� ��
A. P3��P2��T3��T2 B. P1��P3��T1��T3 C. P2��P4��T4��T2 D. P1��P4��T2��T3
���ں����ܱ������ﰴ�����Ϊ1:2����һ����̼��������һ�������·�Ӧ�ﵽƽ��״̬�����ı䷴Ӧ��ijһ�����������б仯��˵��ƽ��һ�����淴Ӧ�����ƶ����� ��
A. ����Ӧ������������С B. �淴Ӧ������������С
C. ��ѧƽ�ⳣ��Kֵ��С D. ������ת���ʼ�С
�� ij�¶��£���4.0molCO��8.0molH2�����ݻ�Ϊ2L���ܱ������У���Ӧ�ﵽƽ��ʱ����ö����ѵ��������Ϊ25%������¶��·�Ӧ��ƽ�ⳣ��K��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��17�֣��о����������������ڴ����к������ӵ������ʱ���漰���·�Ӧ��
2NO2��g��+NaCl��s��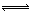 NaNO3��s��+ClNO��g�� K1 ?H < 0 ��I��
NaNO3��s��+ClNO��g�� K1 ?H < 0 ��I��
2NO��g��+Cl2��g��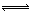 2ClNO��g�� K2 ?H < 0 ��II��
2ClNO��g�� K2 ?H < 0 ��II��
��1��4NO2��g��+2NaCl��s��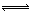 2NaNO3��s��+2NO��g��+Cl2��g����ƽ�ⳣ��K= ����K1��K2��ʾ����
2NaNO3��s��+2NO��g��+Cl2��g����ƽ�ⳣ��K= ����K1��K2��ʾ����
��2��Ϊ�о���ͬ�����Է�Ӧ��II����Ӱ�죬�ں��������£���2L�����ܱ������м���0.2mol NO��0.1mol Cl2��10minʱ��Ӧ��II���ﵽƽ�⡣���10min��v��ClNO��=7.5��10-3mol?L-1?min-1����ƽ���n��Cl2��= mol��NO��ת���ʧ�1= �������������ֲ��䣬��Ӧ��II���ں�ѹ�����½��У�ƽ��ʱNO��ת���ʧ�2 ��1���>����<����=������ƽ�ⳣ��K2 ���������С�����䡱����ҪʹK2��С���ɲ��õĴ�ʩ�� ��
��3��ʵ���ҿ���NaOH��Һ����NO2����ӦΪ2NO2+2NaOH=NaNO3+NaNO2+H2O����0.2mol NaOH��ˮ��Һ��0.2mol NO2ǡ����ȫ��Ӧ��1L��ҺA����ҺBΪ0.1mol?L?1��CH3COONa��Һ��������Һ��c��NO3?����c��NO2-����c��CH3COO?���ɴ�С��˳��Ϊ ������֪HNO2�ĵ��볣��Ka=7.1��10-4mol?L?1��CH3COOH�ĵ��볣��K a=1.7��10-5mol?L?1����ʹ��ҺA����ҺB��pH��ȵķ����� ��
a������ҺA�м�����ˮ b������ҺA�м�����NaOH
c������ҺB�м�����ˮ d������ҺB�м�����NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��6�֣���6molA�����2molB������2L�ܱ������л�ϲ���һ�������·�����Ӧ��3A��g��+B��g�� xC��g��+2D��g��������5min��Ӧ�ﵽƽ��״̬�������ڵ�ѹǿ��С����֪D��ƽ����Ӧ����Ϊ0.2mol/��L?min��,����д���пհף�
xC��g��+2D��g��������5min��Ӧ�ﵽƽ��״̬�������ڵ�ѹǿ��С����֪D��ƽ����Ӧ����Ϊ0.2mol/��L?min��,����д���пհף�
��x����ֵΪ �� ��A��ƽ����Ӧ����Ϊ �� ��5minʱB��ת����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̡�
��1����ˮ����ͨ�����ȵ�̿���ɲ���ˮú������ӦΪ��C(s)��H2O(g)  CO(g)��H2(g) ��H����131.3 kJ��mol��1һ���¶��£���һ���ݻ��ɱ���ܱ������У�����������Ӧ���������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬���� (����ĸ����ͬ)
CO(g)��H2(g) ��H����131.3 kJ��mol��1һ���¶��£���һ���ݻ��ɱ���ܱ������У�����������Ӧ���������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬���� (����ĸ����ͬ)
A�������е�ѹǿ����
B��1 mol H��H�����ѵ�ͬʱ����2 mol H��O��
C��v��(CO)��v��(H2O)
D��c(CO)��c(H2)
��2������ͬ����CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2 L�ĺ����ܱ������У����з�ӦCO(g)��H2O(g)  CO2(g)��H2(g)���õ������������ݣ�
CO2(g)��H2(g)���õ������������ݣ�
| ʵ �� �� | �� �� /�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
 CH3OH(g) +H2O(g)����ͼ��ʾ�÷�Ӧ���й���������(��λΪkJ��mol��1)�ı仯�������Ϊ1 L�ĺ����ܱ������У�����1 mol CO2��3 mol H2�� ���д�ʩ����ʹ c(CH3OH)�������
CH3OH(g) +H2O(g)����ͼ��ʾ�÷�Ӧ���й���������(��λΪkJ��mol��1)�ı仯�������Ϊ1 L�ĺ����ܱ������У�����1 mol CO2��3 mol H2�� ���д�ʩ����ʹ c(CH3OH)������� 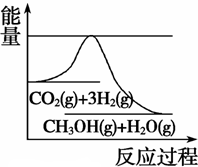
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com