
分析 (1)同一主族中,从上向下,元素第一电离能逐渐减小,同一周期中,元素的第一电离能随着原子序数的增大而增大,但N元素的最外层电子处于半满状态,是一种稳定结构,所以它的第一电离能高于同周期相邻的元素,据此判断;
(2)①硫酸铜溶于水,铜离子与水生成了呈蓝色的配合离子[Cu(H2O)4]2+,该络合离子为平面正方形;
②Co(NH3)5BrSO4可形成两种配合物,Co3+的配位数是6,在第一种配合物的溶液中加BaCl2 溶液时,产生白色沉淀,该物质可以电离出SO42-,故配体为NH3、Br-,该物质结构为[Co(NH3)5Br]SO4,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,该物质不能电离出SO42-,故配体为NH3、SO42-,该物质为[Co(NH3)5SO4]Br;
(3)d区包含ⅢB~ⅦB(镧系元素、锕系元素除外)、第Ⅷ族,据此判断;
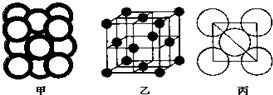
(4)由晶胞结构可知,以顶点Al原子为研究对象,与之最近的Al原子处于面心上,结合Al的摩尔质量计算晶胞质量,Al的原子半径为r,则晶胞棱长为$2\sqrt{2}$r,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)同一主族中,从上向下,元素第一电离能逐渐减小,同一周期中,元素的第一电离能随着原子序数的增大而增大,但N元素的最外层电子处于半满状态,是一种稳定结构,所以它的第一电离能高于同周期相邻的元素,所以C、N、O、S四种元素的第一电离能由小到大的顺序为C<S<O<N,
故答案为:C<S<O<N;
(2)①硫酸铜溶于水,铜离子与水生成了呈蓝色的配合离子[Cu(H2O)4]2+,离子方程式为Cu2++4H2O=[Cu(H2O)4]2+,该络合离子为平面正方形,
故答案为:平面正方形;Cu2++4H2O=[Cu(H2O)4]2+;
②Co(NH3)5BrSO4可形成两种配合物,Co3+的配位数是6,在第一种配合物的溶液中加BaCl2 溶液时,产生白色沉淀,该物质可以电离出SO42-,故配体为NH3、Br-,该物质结构为[Co(NH3)5Br]SO4,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,该物质不能电离出SO42-,故配体为NH3、SO42-,该物质为[Co(NH3)5SO4]Br,
故答案为:[Co(NH3)5SO4]Br;
(3)Co属于第Ⅷ族元素,所以Co属于d区,
故答案为:d;
(4)由晶胞结构图可知,以顶点原子为研究对象,与之最近的原子处于面心上,每个顶点原子为12个面共用,故晶胞中该原子的配位数为12,晶胞中Al原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为4×$\frac{M}{{N}_{A}}$,Al的原子半径为r,则晶胞棱长为$2\sqrt{2}$r,故Al晶胞的密度ρ=$\frac{m}{V}$=4×$\frac{M}{{N}_{A}}$÷($2\sqrt{2}$r)3=$\frac{M}{4\sqrt{2}{N}_{A}{r}^{3}}$,
答:12;$\frac{M}{4\sqrt{2}{N}_{A}{r}^{3}}$.
点评 本题考查第一电离能的比较、配合物的形成和结构判断、晶胞计算,注意利用均摊法计算晶胞质量,需要学生具有一定的数学计算能力,难度中等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 可以用分液漏斗分离硝基苯和苯 | |
| B. | 加浓溴水,然后过滤可以除去苯中少量乙烯 | |
| C. | 苯、溴水、铁粉混合制得溴苯 | |
| D. | 用溴水可以鉴别苯、乙醇、苯乙烯( ) ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,反应类型:取代反应.
,反应类型:取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④③① | B. | ②④①③ | C. | ②①④③ | D. | ④②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙溶于醋酸CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 锌片插入硝酸银溶液中Zn+Ag+═Zn2++Ag | |
| C. | 在稀氨水中通入过量CO2:NH3•H2O+CO2═NH4++HCO3- | |
| D. | 硫酸镁溶液和氢氧化钡溶液反应 SO42-+Ba2+═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R | B. | 单质与稀盐酸反应的速率为L<Q | ||
| C. | M与T、Q与 T形成的化合物性质相似 | D. | L2+与R2-的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| I | Ii | Iii | |
| 备选装置 |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1>Q2 | B. | Q1<Q2 | C. | Q1=Q2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度可使该反应的正逆反应速率同时增大 | |
| B. | 单位时间内消耗CO和NO的物质的量相等时,反应达到平衡 | |
| C. | 反应达到平衡后,NO的反应速率保持恒定 | |
| D. | 使用高效催化剂可增大反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com