
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
分析 采用换元法,将氯原子代替氢原子,氢原子代替氯原子,二氯代物的同分异构体数目=六氯代物的同分异构体数目来解答.
解答 解:丙烷的二氯代物的异构体为:CHCl2CH2CH3,CH3CCl2CH3,CH2ClCHClCH3,CH2ClCH2CH2Cl,丙烷有8个H原子,其中2个H原子被氯原子取代形成丙烷的二氯代物,六氯代物可以看作C3Cl8中的8个氯原子,其中2个氯原子被2个氢原子代替形成,两者是等效的,二氯代物有4种同分异构体,可得到六氯代物也有4种同分异构体.
故选C.
点评 本题主要考查了同分异构体的确定,注意解决此类问题的规律:设烃的分子式为CxHy,如果它的m氯代物与n氯代物的同分异构体数目相等,则m+n=y,反之,如果m+n=y,也可知道其同分异构体数目相等.


科目:高中化学 来源: 题型:填空题
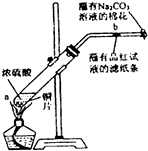
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 25℃时,Mg(OH)2固体在20mL 0.01mol/L的氨水中的Ksp比在20mL0.01mol/L NH4Cl溶液中的Ksp小 | |
| D. | 25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  表示某吸热反应分别在有、无催化剂的情兄下反应过程中的能量变化 | |
| B. | 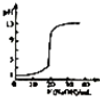 表示常温下,0.1 OOOmoi/LNaOH 溶液液滴定 20.00mL、0.0100/LHCl 溶液 所得到的滴定曲线 | |
| C. | 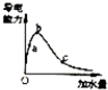 表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c>a>b | |
| D. | 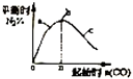 表示反应4CO+2NO2(g)?N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体识分数变化情况,由图可知NO2的转化率 c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )| A. | Z的氧化物对应的水化物一定是一种强酸 | |
| B. | 原子半径大小顺序是X>Y>Z | |
| C. | Y的单质比Z的单质更易与氢气反应 | |
| D. | Z的单质与Fe反应形成的化合物中,铁元素显+3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com