
| 溶液 | A | B | C | D |
| 加入盐酸后的现象 | 无明显变化 | 无明显变化 | 有气泡产生 | 无明显变化 |
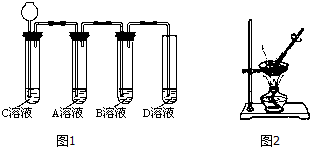
分析 (1)溶液带色,实际溶液中的离子所显的颜色,初中阶段所接触的物质中,带色的离子有:铁离子显棕黄色,亚铁离子显浅绿色,铜离子显蓝色,高锰酸根离子显紫色.
(3)加入盐酸有气泡产生的,溶液中含有碳酸根;根据各组中的溶液成份,要生成白色沉淀,只能是碳酸钙沉淀.
(4)可以根据能产生气体判断出碳酸钠,根据生成沉淀判断出氢氧化钙,氢氧化钠显碱性,氯化钠显中性.
解答 解:(1)①溶液所显的颜色,实际是由溶液中的离子显示出的,我们所学过的带色的离子有:铁离子显棕黄色,亚铁离子显浅绿色,铜离子显蓝色,高锰酸根离子显紫色.故答案为:KMnO4和CuSO4 ;
(3)A、B、C、D溶液,然后依次加入少量盐酸,加入盐酸能产生气泡的,则说明溶液中应该含有碳酸根,根据各组中的溶液成份,要生成白色沉淀,只能是氢氧化钙与二氧化碳反应生成碳酸钙沉淀,A溶液中发生反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O;取少量B溶液倒入蒸发皿,加热,闻到有刺激性气味,停止加热.再取少量D溶液倒入另一蒸发皿,加热,有白色固体析出,停止加热.实验结论:B是稀盐酸,D是 NaCl溶液,第5种无色溶液是NaOH溶液,C溶液中发生反应的化学方程式为Na2CO3+2HCl=2NaCl+CO2↑+H2O,故答案为:Na2CO3;CO2+Ca(OH)2═CaCO3↓+H2O;Na2CO3+2HCl=2NaCl+CO2↑+H2O;稀盐酸;NaCl溶液;NaOH溶液;
(4)取2支试管,分别加入少量的A、B溶液,然后依次加入少量的C溶液,A溶液中有白色沉淀生成,A是氢氧化钙溶液;B溶液中有无色气泡逸出,B是盐酸,故答案为:有白色沉淀产生.
点评 本题综合考查了根据题中所给的条件对物质的推导,以及根据现象完成鉴别过程,难度较大,综合性强.


科目:高中化学 来源: 题型:计算题
| 气体名称 | 状况 | 质量 (g) | 体积 (mL) | 摩尔质量(g/mol) | 1mol气体的体积 |
| A | 某温度,常压 | 0.14 | 120 | 28 | 24L |
| B | 标准状况 | 0.98 | 500 | 44 | 22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
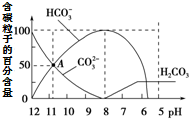 常温下在20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HCl溶液40mL,溶液中含碳粒子的百分含量随pH的变化如图所示.下列说法不正确的是( )
常温下在20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HCl溶液40mL,溶液中含碳粒子的百分含量随pH的变化如图所示.下列说法不正确的是( )| A. | 0.1 mol•L-1 Na2CO3溶液中:c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+) | |
| B. | A点:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| C. | 0.05 mol•L-1 NaHCO3溶液的pH=8 | |
| D. | pH=7时混合液中c(Na+)=2c(CO32-)+c(HCO3-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4溶液中c(Na+)=c(OH-)+c(HSO${\;}_{4}^{-}$)+2c(SO${\;}_{4}^{2-}$) | |
| B. | 混合后溶液pH值为13 | |
| C. | 混合溶液中c(Ba2+)+c(Na+)+c(H+)=c(SO${\;}_{4}^{2-}$)+c(OH-) | |
| D. | 加入Ba(OH)2溶液后混合溶液水电离程度比纯水的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| B. | 标准状况下,22.4L N2和H2的混合气中含NA个原子 | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,22.4L氨水含有NA个NH3分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:11 | B. | 16:9 | C. | 8:11 | D. | 32:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R一定是非金属元素 | B. | R的最高价氧化物为R2O5 | ||
| C. | 最高价氧化物对应水化物H2RO4 | D. | R的气态氢化物为RH5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com