
(12分)回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图。
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式:
▲ 。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是:
▲ 。
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为: ▲ 。温度对GeCl4的水解率产生的影响如右图所示。为控制最佳的反应温度,实验时可采取的措施为 ▲ 。(填字母)
A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)根据下表1 中不同pH下二氧化锗的溶解率,结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH 变化的原因 ▲ ,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应 ▲ 。
表1 不同pH下二氧化锗的溶解率
| pH | 4 | 5 | 6 | 7 | 8 | 9 |
| 溶解率/% | 47.60 | 32.53 | 11.19 | 5.27 | 1.96 | 8.85 |
(1)Ge2++H2O2+2H+=Ge4++2H2O (2)抑制GeCl4水解
(3)GeCl4+ (2+n) H2O = GeO2·nH2O+ 4HC1 C
(4)二氧化锗具有两性, GeO2+2OH-=GeO+H2O
解析(1)根据氧化还原反应的本质:锗的失去电子,化合价上升;则氧得到电子,化合价下降生成水。再根据化学反应前后原子守恒,可配平化学反应:Ge2++H2O2+2H+=Ge4++2H2O
(2)-(3):由于GeCl4强酸弱碱盐,在加热的很容更易发生水解反应,即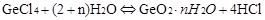 ,当加入浓盐酸可以抑制反应向右进行,即抑制水解。温度越低越不利于水解反应,冰盐水可以降低冰的凝固点,使温度更低。所以选C。
,当加入浓盐酸可以抑制反应向右进行,即抑制水解。温度越低越不利于水解反应,冰盐水可以降低冰的凝固点,使温度更低。所以选C。
(4)锗的对角是铝,氧化铝是两性金属氧化物,既可以与酸反应,又可以与碱反应。所以氧化锗是两性氧化物,既可以与酸反应,又可以与碱反应,且酸碱性越强反应越剧烈。当pH>8时,生成偏锗酸盐和水,即GeO2+2OH-=GeO32-+H2O。


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:

 如图1所示,其原因是
如图1所示,其原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图。
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式:
▲ 。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是:
▲ 。
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为: ▲ 。温度对GeCl4的水解率产生的影响如右图所示。为控制最佳的反应温度,实验时可采取的措施为 ▲ 。(填字母)
A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)根据下表1 中不同pH下二氧化锗的溶解率,结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH 变化的原因 ▲ ,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应 ▲ 。
表1 不同pH下二氧化锗的溶解率
| pH | 4 | 5 | 6 | 7 | 8 | 9 |
| 溶解率/% | 47.60 | 32.53 | 11.19 | 5.27 | 1.96 | 8.85 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省揭阳市高三上学期期末考试理综化学试卷(解析版) 题型:填空题
回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图:

(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式 。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是 。实验室蒸馏操作时常用的玻璃仪器有:酒精灯、蒸馏烧瓶、 、 、接收管、锥形瓶等。
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为 。
温度对GeCl4的水解率产生的影响如图1所示,其原因是 。 为控制最佳的反应温度,实验时可采取的措施为 (填序号)。

A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH 变化的原因 ,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应 。
|
pH |
4 |
5 |
6 |
7 |
8 |
9 |
|
溶解率/% |
47.60 |
32.53 |
11.19 |
5.27 |
1.96 |
8.85 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省广州市番禺区高三统考(二)理综化学试卷(解析版) 题型:填空题
回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图。

(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式 。
(2)蒸馏可获GeCl4,在此过程中加入浓盐酸的原因是 。
(3)GeCl4水解生成GeO2·nH2O,化学方程式为 。温度对GeCl4的水解率产生的影响如图1所示,其原因是该水解反应ΔH 0(“>”或“<”)。为控制最佳的反应温度,实验时可采取的措施为 水浴。

A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)已知Ge的单质和化合物性质与Al的相似,试用离子方程式表示在pH>8的溶液中GeO2逐渐溶解时发生的反应 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com