
| A. | 小苏打可以治疗胃酸过多,是利用了小苏打的酸性 | |
| B. | 与足量等浓度盐酸溶液反应的速率:NaHCO3<Na2CO3 | |
| C. | 久置在空气中的钠最后变成碳酸钠晶体 | |
| D. | 某未知样品灼烧时能使火焰呈黄色,说明该样品中肯定含有钠元素 |
分析 A.小苏打为碳酸氢钠,水解显碱性;
B.碳酸氢钠与盐酸反应速率较快;
C.氢氧化钠再与空气中的二氧化碳反应生成碳酸钠和水,最终变成白色粉末为碳酸钠;
D.焰色反应是元素的性质,钠元素灼烧显黄色.
解答 解:A.小苏打溶液显碱性,能够与盐酸反应,中和胃酸,故A错误;
B.相同条件下NaHCO3比Na2CO3反应放出气体剧烈,产生气体的速率:Na2CO3<NaHCO3,故B错误;
C.生成的氢氧化钠再与空气中的二氧化碳反应生成碳酸钠的结晶水合物,最终风化变成白色粉末为碳酸钠,故C错误;
D.钠元素灼烧显黄色,某未知样品灼烧时能使火焰呈黄色,说明该样品中肯定含有钠元素,故D正确;
故选:D.
点评 本题考查了元素化合物知识,熟悉碳酸钠及碳酸氢钠等的性质即可解答,注意焰色反应为元素的性质.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| ① | Mg Al | 稀盐酸 | 偏向Al |
| ② | Al Cu | 稀盐酸 | 偏向Cu |
| ③ | Al 石墨 | 稀盐酸 | 偏向石墨 |
| ④ | Mg Al | NaOH溶液 | 偏向Mg |
| ⑤ | Al Cu | 浓硝酸 | 偏向Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+Cl2(g)=2HCl(g) 和H2(g)+Cl2(g)=2HCl(aq) | |
| B. | C2H4(g)+H2(g)=C2H6(g)和C3H6(g)+H2(g)=C3H8(g) | |
| C. | 2H2(g)+O2(g)=2H2O(l)和2H2(g)+O2(g)=2H2O(g) | |
| D. | C(s)+O2(g)=CO2(g)和C(s)+$\frac{1}{2}$O2(g)=CO(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气和臭氧互为同素异形体 | |
| B. | CH3-CH2OH和 CH3-O-CH3互为同分异构体 | |
| C. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | |
| D. | ${\;}_{2}^{4}$He的最外层电子数为2,所以${\;}_{2}^{3}$He具有较强的金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
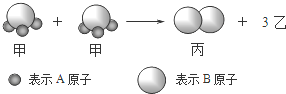
| A. | 1个乙分子中含有2个A原子 | B. | 摩尔质量关系为:2M (甲)=M (乙)+M (丙) | ||
| C. | 该反应一定属于氧化还原反应 | D. | 该反应类型是分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
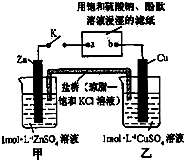
| A. | 片刻后可观察到滤纸a点变红色 | B. | 电子沿Zn→a→b→Cu路径流动 | ||
| C. | 片刻后甲池中c(SO42-)增大 | D. | 盐桥中的Cl-向Cu极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
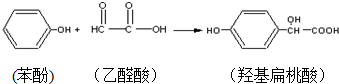
| A. | 苯酚和羟基扁桃酸互为同系物 | |
| B. | 标准状况下,22.4L羟基扁桃酸中共用电子对的数目为24NA | |
| C. | 乙醛酸的核磁共振氢谱图只有一组峰 | |
| D. | 羟基扁桃酸分子中至少有12个原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
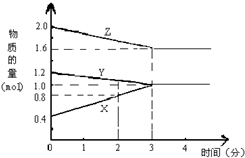 某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com