
| A.100mL | B.50mL | C.25mL | D.无法判断 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B.纯二氧化硅大量用于制造光导纤维 |
| C.Al2O3的熔点很高,可用于制作耐高温材料 |
| D.电解MgCl2饱和溶液,可制得金属镁 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属AI无剩余 | B.c(Na+)=c(AlO-2) |
| C.所得溶液呈碱性 | D.Na的物质的量是0.6mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A. mol·L-1 mol·L-1 | B.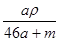 mol·L-1 mol·L-1 | C.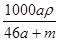 mol·L-1 mol·L-1 | D.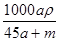 mol·L-1 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
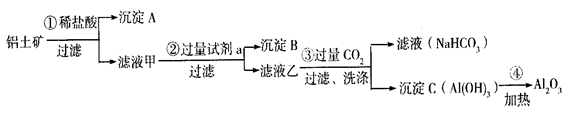
 A、B的成分分别是 、 ;步骤② 中的试剂a是 ;
A、B的成分分别是 、 ;步骤② 中的试剂a是 ; 中存在Fe3+的操作方法:__________ _。
中存在Fe3+的操作方法:__________ _。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 : 1 | B.2 : 3 | C.2 : 1 | D.3 : 2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
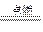 2MgO;②3Mg+N2
2MgO;②3Mg+N2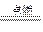 Mg3N2;
Mg3N2;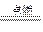 2MgO+C ④Mg+H2O
2MgO+C ④Mg+H2O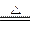 MgO+H2↑ ⑤Mg3N2 +6H2O ===3Mg(OH)2+2NH3↑
MgO+H2↑ ⑤Mg3N2 +6H2O ===3Mg(OH)2+2NH3↑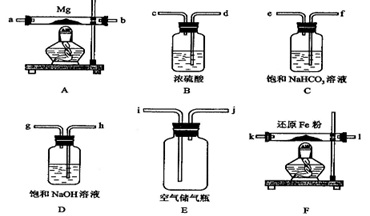
| 装置 | 目的 |
| | |
| | |
| | |
| | |
 ;
;查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
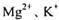 杂质离子并尽可能减少AlCI3的损失:请回答下列问题:
杂质离子并尽可能减少AlCI3的损失:请回答下列问题:
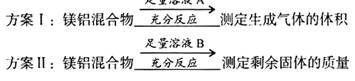
| A.溶液A选用NaOH溶液 |
| B.若溶液B选用浓硝酸.则测得镁的质量分数偏小 |
| C.溶液A和B均可选用稀硝酸 |
| D.实验室屮方案II更便于实施 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 硫酸转移到容量瓶中。
硫酸转移到容量瓶中。 盖上容量瓶塞子,振荡,摇匀。
盖上容量瓶塞子,振荡,摇匀。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com