
| A. | 向FeCl2溶液中通入Cl2反应生成FeCl3溶液:Fe2++Cl2═Fe3++2Cl- | |
| B. | CO2通入过量的NaOH溶液:CO2+OH-═HCO3- | |
| C. | 大理石溶于硝酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 碳酸钡和稀硫酸:BaCO3+2H+═Ba2++CO2↑+H2O |
分析 A.电子、电荷不守恒;
B.反应生成碳酸钠和水;
C.反应生成硝酸钙、水、二氧化碳,碳酸钙在离子反应中保留化学式;
D.反应生成硫酸钡沉淀,碳酸钡、硫酸钡在离子反应中均保留化学式.
解答 解:A.向FeCl2溶液中通入Cl2反应生成FeCl3溶液的离子反应为2Fe2++Cl2═2Fe3++2Cl-,故A错误;
B.CO2通入过量的NaOH溶液的离子反应为CO2+2OH-═CO32-+H2O,故B错误;
C.大理石溶于硝酸的离子反应为CaCO3+2H+═Ca2++CO2↑+H2O,故C正确;
D.碳酸钡和稀硫酸:BaCO3+2H++SO42-═BaSO4↓+CO2↑+H2O,故D错误;
故选C.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,注意氧化还原反应及离子反应中保留化学式的物质,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该烃是苯的同系物 | |
| B. | 该烃分子中至少有9个碳处于同一平面上 | |
| C. | 该烃分子中的所有原子有可能处于同一平面上 | |
| D. | 该烃的一氯代物最多有四种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向次氯酸钙溶液通过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 向Ca(HCO3)2溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+CO32-+H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+=3I2+3H2O | |
| D. | 氢氧化钡溶液中加入硫酸:Ba2++OH-+H++SO42-═BaSO4+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
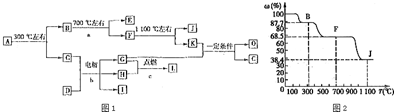
 .
.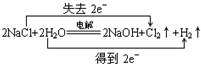 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
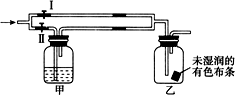 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,若关闭Ⅱ阀,打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,若关闭Ⅱ阀,打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com