
在碘酸钠(NaIO3)的碱性溶液中通入氯气,可以得到高碘酸钠(Na2H3IO6)。下列有关该反应的说法错误的是( )
A.在该反应中碘酸钠作还原剂
B.碱性条件下,氯气的氧化性强于高碘酸钠的氧化性
C.反应中生成1 mol Na2H3IO6转移2 mol电子
D.反应中氧化产物与还原产物的物质的量之比为2∶1
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
已知1 mol红磷转化为1 mol白磷,吸收18.39 kJ热量。
①4Ps,红)+5O2g)===2P2O5s) ΔH1
②4Ps,白)+5O2g)===2P2O5s) ΔH2
则ΔH1与ΔH2的关系正确的是 )。
A.ΔH1=ΔH2 B.ΔH1>ΔH2
C.ΔH1<ΔH2 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
Fe2+和I-是两种常见的还原性离子。
(1)向FeSO4溶液中滴加氯水,溶液由浅绿色变成黄色,反应的离子方程式为__________________(2分);
向KI溶液中滴加氯水,溶液由无色变成黄色,反应的离子方程式为______________________ (2分)。
(2)请以FeSO4溶液、KI溶液、氯水为试剂探究Fe2+和I-的还原性强弱。
①提出假设:假设1:Fe2+还原性强于I-;假设2:_____________________________(1分)
②设计实验方案,写出实验步骤、预期现象和结论。其他限选试剂:3 mol·L-1 H2SO4、0.01 mol·L-1 KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液。
| 实验步骤(6分) | 预期现象与结论(2分) |
| 步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再_________ __ | 现象:溶液变成黄色。结论:可能是生成了Fe3+、也可能是生成了I2。 |
| 步骤2:___________________________
|
|
(3)利用(2)②中提供的试剂证明碘与铁的化合物中铁显+2价,实验操作和现象是:
取少量样品溶于水,______________________________________________________。(3分)
查看答案和解析>>
科目:高中化学 来源: 题型:
在298 K时,下列反应的ΔH依次为:
C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l)
ΔH1=-1 366.8 kJ·mol-1
C(石墨)+O2(g)===CO2(g)
ΔH2=-393.5 kJ·mol-1
H2(g)+1/2O2(g)===H2O(l)
ΔH3=-285.8 kJ·mol-1
乙醇(C2H5OH)、氢气、石墨和氧气的熵值分别为:161.0 J·mol-1·K-1、130.6 J·mol-1·K-1、5.74 J·mol-1·K-1、205.3 J·mol-1·K-1,则298 K时,由单质生成1 mol 乙醇的ΔH、ΔS及ΔH-TΔS分别为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
H2O2是一种绿色氧化还原试剂,写出H2O2分解反应方程式并标明电子转移的方向和数目:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+===Fe3++Ce3+
Sn2++2Fe3+===2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )
A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ce3+
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上,通过如下转化可制得KClO3晶体:
NaCl溶液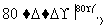 NaClO3溶液
NaClO3溶液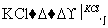 KClO3晶体
KClO3晶体
①完成Ⅰ中反应的总化学方程式: NaCl+
NaCl+ H2O===
H2O=== NaClO3+
NaClO3+ __________。
__________。
②Ⅱ中转化的基本反应类型是________,该反应过程能析出KClO3晶体而无其他晶体析出的原因是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,将2 mol A和2 mol B两种气体混合放入体积为2 L的 密闭刚性容器中,发生反应:3A(g)+B(g)
密闭刚性容器中,发生反应:3A(g)+B(g)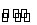 xC(g)+2D(g)
xC(g)+2D(g)
2 min末反应达到平衡,生成0.8 mol D,并测得C的浓度为0.4 mol·L-1,下列说法正确的是( )
D,并测得C的浓度为0.4 mol·L-1,下列说法正确的是( )
A.x的值为1
B.A的转化率为40%
C.此温度下该反应的平衡常数K等于0.5
D.A和B的平衡转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,反应A2(g)+B2(g)
 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )
A.单位时间内生成n mol的A2,同时生成n mol的AB
B.容器内的总压强不随时间的变化而变化
C.单位时间内生成2n mol的AB同时生成n mol的B2
D.平均相对分子质量不随时间变化而变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com