
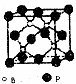
 硼是新型无机材料中的明星元素.
硼是新型无机材料中的明星元素.| 1 |
| 8 |
| 1 |
| 2 |
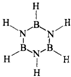 ;
; ;
;| 1 |
| 2 |
| 1 |
| 2 |
| 3+1-1×4 |
| 2 |


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
| A、2-甲基丁烷和戊烷 |
| B、乙二醇和丙三醇 |
| C、2,2-二甲基-1-丙醇和2-甲基-2-丁醇 |
| D、苯甲醇和对甲基苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气是合成塑料、橡胶、农药和制盐酸、有机溶剂的重要原料 |
| B、“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 |
| C、白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去 |
| D、“雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用相对分子质量大小可以判断某些物质的熔沸点高低 |
| B、利用密度数据可判断液体物质挥发性的大小 |
| C、利用原子(或离子)半径数据可推断某些原子(或离子)的氧化性和还原性的强弱 |
| D、利用溶解度数据可推测将一些物质混合物分离开来的可能性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸铝溶液中加入过量烧碱:Al3++3OH-=Al(OH)3↓ |
| B、碳酸钠溶液中加入醋酸:CO32-+2H+=CO2↑+H2O |
| C、碳酸氢钠溶液中加入氢氧化钠:HCO3-+OH-=CO32-+H2O |
| D、常温时,浓硝酸中加入铁片:Fe+6H++3NO3-=Fe3++3NO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com