
NaClO2可用作造纸的漂白剂,它由H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2制得,下列说法正确的是
A.H2O2是氧化剂,H2O2中的氧元素被还原
B.每生成1 mol O2转移的电子的物质的量为4 mol
C.ClO2中的氯元素被氧化
D.ClO2是氧化剂,H2O2是还原剂
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
从海水中提取镁是世界各国获得镁的主要来源,以下是制取镁的过程中涉及的几种物质的溶度积,根据你所学的知识回答下列几个问题:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
| 溶度积 | 2.8×10﹣9 | 6.8×10﹣6 | 5.5×10﹣6 | 1.8×10﹣11 |
(1)在从海水中提取镁时,往往用到贝壳(主要成份是碳酸钙),你认为 不能 (填“能”或“不能”)将贝壳研磨成粉末直接投入海水中,理由是 贝壳研磨成粉末仍是CaCO3,由于CaCO3比MgCO3还要难溶,所以将其直接投入海水中不能产生MgCO3 ;如果不能直接投入,应将贝壳作何处理,试写出化学方程式 CaCO3\frac{\underline{\;高温\;}}{\;}CaO+CO2↑ .
(2)某同学在实验室条件下模拟该生产过程,但实验室无石灰,他打算用烧碱代替,你认为 可以 (填“可以”或“不可以”)得到Mg(OH)2.在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他 能 (填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是 Mg2++CO32﹣=MgCO3 MgCO3+2OH﹣=Mg(OH)2+CO32﹣ .(用离子方程式表示)
(3)已知海水中镁离子浓度为1.8×10﹣3mol/L,则要使镁离子产生沉淀,溶液的pH最低应为 10 .
查看答案和解析>>
科目:高中化学 来源: 题型:
水溶液中能大量共存的一组离子是
A.Na+、Ca2+、Cl-、SO42-
B.Fe2+、H+ 、SO32-、ClO-
C.Mg2+、NH4+、Cl- 、SO42-
D.K+、Fe3+、NO3-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过反应:Al2O3+N2+ 3C
3C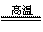 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1 mol AlN需转移3 mol电子
C.AlN中氮的化合价为+3
D.AlN的摩尔质量为41 g
查看答案和解析>>
科目:高中化学 来源: 题型:
铜和浓硫酸发生反应的化学方程式为: Cu +2H2SO4(浓)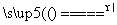 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(1)浓H2SO4作____ _____剂,具有 性。
_____剂,具有 性。
(2)在该反应中,若消耗了32 g Cu,则转移了_______mol 电子,还原了 mol H2SO4,生成 L SO2(标准状况)气体。
(3)以下三种物质的氧化性由 强到弱的顺序为: (写出序号)
强到弱的顺序为: (写出序号)
①浓H2SO4 ②稀H2SO4 ③CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+===Fe3++Ce3+
Sn2++2Fe3+===2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是 ( )
A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ce3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com